
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетический подход к состоянию химического равновесия
С позиций химической кинетики химическое равновесие наступает тогда, когда скорость прямой реакции становится равной скорости обратной реакции:
где Кр – константа химического равновесия, величина, характеризующая степень протекания реакции; для любого химического равновесия Кр является безразмерной величиной. NB! На величину константы химического равновесия оказывает влияние только температура системы и природа веществ, и не влияют концентрации веществ, давление и объем системы. В случае гетерогенного равновесия в выражение для Кр попадают только концентрации (парциальные давления) газов, если они есть или только концентрации соединений, находящихся в растворе. Концентрации твердых веществ никогда не попадают в выражение константы химического равновесия. Термодинамический подход к состоянию химического равновесия Изменение свободной энергии Гиббса DG связано со стандартным изменением свободной энергии Гиббса DG0 и концентрациями веществ в химической системе следующим уравнением:
Стандартным изменением энергии Гиббса DG0 называется изменение свободной энергии при стандартных условиях (P0 = 1 атм, Т = 273 К) и концентрациях веществ 1 моль/л. С позиций термодинамики, равновесие наступает тогда, когда система приходит к минимуму свободной энергии или, другими словами, когда DGТ = 0. В этом случае выражение, находящееся под логарифмом, превращается в константу химического равновесия:
DGТ < 0 – процесс возможен DGТ > 0 – процесс невозможен DGТ = 0 – химическое равновесие DGТ0 < 0, lnKP > 0, KP > 1 DGТ0 > 0, lnKP < 0, KP < 1 DGТ0 = 0, lnKP = 0, KP = 1 DGТ –возможность протекания процесса; DGТ0 – мера протекания процесса (КР). Равновесие реализуется в интервале DG0 = ±50 кДж. Задачи к разделу 1. Определите понятия a) «истинное химическое равновесие», b) «ложное химическое равновесие», c) равновесие гомогенное и гетерогенное. 2. Сформулируйте закон действующих масс для химического равновесия. 3. Что такое константа химического равновесия? 4. Принцип Ле–Шателье. 5. В системе N2(г) + 3H2(г)
6. При смешении 1,0 моль HCl с 0,48 моль O2 образовалось 0,40 моль хлора. Давление в системе равно 1 атм. Определите константу равновесия 4HCl(г) + O2(г) 7. Константа равновесия CO2(г) + H2(г) равна 1. В каких объемных отношениях были смешаны CO2 и H2, если к моменту равновесия 90% водорода превратилось в воду? 8. Константа равновесия Fe2O3(кр) + 3CO(г) при температуре T равна 0,4. Исходные концентрации CO и CO2 равны соответственно 0,2 и 0,1 моль/л. Найдите равновесные концентрации. 9. Константа равновесия реакции 2NO(г) + O2(г) равна 2,2. Равновесная концентрация оксида азота равна 0,02 моль/л, а диоксида – 0,03 моль/л. Определите исходную концентрацию O2. 10. Исходные концентрации оксида углерода и хлора равны 0,03 и 0,02 моль/л. Равновесная концентрация CO равна 0,021 моль/л. Определите равновесные концентрации хлора и фосгена в реакции CO(г) + Cl2(г) 11. Исходная концентрация CO равна 0,05 моль/л, а хлора – 0,06 моль/л. Реакция CO(г) + Cl2(г) протекает в замкнутом сосуде емкостью 1 л. Вычислите исходное давление и давление в момент, когда 50% CO прореагирует, если начальная температура 20°C, а конечная 50°C. 12. Константа равновесия A(г) + B(г) равна 1. Начальные концентрации A и B равны соответственно 0,02 и 0,10 моль/л. Сколько моль/л A подверглось превращению при данных условиях? 13. Константу равновесия CO(г) + H2O(г) выразите через константы двух других равновесий: 2CO(г) + О2(г) 2H2(г) + O2(г) 14. Укажите (качественно), какие изменения условий (температура, давление) благоприятствуют смещению равновесий вправо: a) H2(г) + S(кр) b) 2O3(г) c) HCl(г) d) CO2(г) + H2O(г) 15. Оцените, при какой температуре константа равновесия 2SO2(г) + O2(г) 16. Оцените температуру, при которой давление диссоциации CaCO3 достигает 1 атм. Какие допущения используются при этой оценке?
17. Константа равновесия Kp реакции NH4Cl(кр) при 25°С равна 10 – 16, DH°298 реакции равна 177,1 кДж. Найдите температуру, при которой давление диссоциации достигает 1 атм. 18. Константа равновесия реакции 2HI(г) при 360°C равна 0,0162, а при 445°C равна 0,0240. Вычислите термодинамические характеристики процесса диссоциации йодоводорода. 19. Вычислите начальные концентрации исходных аминокислот, константу равновесия (Кр) и DG0298 реакции образования дипептида: аланин + глицин = аланинглицин, если равновесные концентрации реагентов следующие: [аланин] = [глицин] = 1,5 моль/л, [аланинглицин] = 3·10 – 3 моль/л. 20. В биологическом полимере имеет место следующее превращение: нативное состояние причем при повышении температуры равновесие сдвигается вправо: a) что можно сказать о знаке DН° в соответствии с принципом Ле-Шателье? b) если при температуре 60°С величина DG° отрицательна, а DН° положительна, то каков будет знак изменения энтропии этого процесса?
Растворы
|
||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 197; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.53.209 (0.008 с.) |
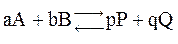
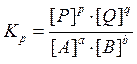
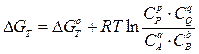
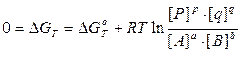
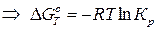
 2NH3(г) начальные концентрации азота и водорода равны соответственно 2 и 6 моль/л. Как изменится давление к моменту равновесия, если наступит оно тогда, когда прореагирует 10% первоначального количества азота? Чему равна константа этого равновесия?
2NH3(г) начальные концентрации азота и водорода равны соответственно 2 и 6 моль/л. Как изменится давление к моменту равновесия, если наступит оно тогда, когда прореагирует 10% первоначального количества азота? Чему равна константа этого равновесия? 2NO2(г)
2NO2(г)


