
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Протолитическая теория (теория Бренстеда-Лоури)
Кислота – донор протонов. Основание – акцептор протонов. Любой кислоте соответствует сопряженное ей основание и наоборот. Чем сильнее кислота, тем слабее сопряженное ей основание. HCl ® Н+ + Cl– NH3 + H+ ® NH4+
Протолитическая диссоциация – процесс самоионизации растворителя (воды, жидкого аммиака NH3, жидкого фтороводорода HF и др.:
Теория Льюиса Кислота – акцептор электронной пары. Основание – донор электронной пары. H+ +: NH3 ® NH4+ кислота основание Свойства растворов электролитов Константа диссоциации Кд – характеристика (константа) равновесия процесса электролитической диссоциации; Ка – константа диссоциации кислоты, К b – константа диссоциации основания. Ступенчатые константы диссоциации – набор последовательных Кд в случае диссоциации многоосновных кислот или многокислотных оснований.
Для любого электролита верно, что Степень диссоциации α связана с константой диссоциации Кд и молярной концентрацией электролита См:
В случае слабого электролита (α << 1), 1 – α ≈ 1 получается
Водородный показатель – рН Чистая вода – слабый электролит, ее диссоциацию можно записать как:
Степень диссоциации воды чрезвычайно мала (a ®0), поэтому [Н2О] – это практически молярная концентрация чистой воды, которая в любом водном растворе является постоянной и составляет [Н2О] ≈ 55,6 М. Следовательно, Кw = КД∙[Н2О] = const, которую называют ионное произведение воды: Кw = [Н+ ][ОН–]= 10–14 В нейтральном растворе [Н+ ]=[ОН–]=10–7 М. Для удобства, вместо величины молярной концентрации протонов и гидроксид-инонов, пользуются водородным показателем pH и гидроксидным показателем pOH: pН = – lg[H+] рОН= – lg[OH-] Для любого водного раствора при стандартных условиях верно, что рН + рОН =14.
Водородный показатель характеризует среду раствора: Ø рН < 7 – кислый раствор; Ø рН = 7 – нейтральный раствор; Ø рН > 7 – щелочной раствор. Экспериментально, водородный показатель раствора рН можно определить с помощью индикатора или рН-метра. Индикатор – сложная органическая кислота или основание, которое меняет свою окраску при изменении рН раствора.
Гидролиз солей. Основные понятия Гидролиз соли – это обменная реакция взаимодействия соли с водой с образованием слабого электролита. Гидролизу подвергаются все соли, за исключением солей, образованных сильным кислотами и сильными основаниями (растворы таких солей нейтральны, рН ≈ 7). · Соли, образованные слабыми кислотами и сильными основаниями, подвергаются гидролизу по аниону:
В результате образования гидроксидных ионов растворы таких солей являются щелочными (рН > 7). · Соли, образованные слабыми основаниями и сильными кислотами, подвергаются гидролизу по катиону:
В результате образования протонов растворы таких солей являются кислыми (рН < 7). · Соли, образованные слабыми основаниями и слабыми кислотами, подвергаются полному (необратимому) гидролизу: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S Ступенчатый гидролиз В случае солей многоосновных слабых кислот или многокислотных слабых оснований гидролиз протекает ступенчато (или, другими словами, происходит ступенчатый гидролиз многозарядного иона): (I) (II) (III) Гидролиз солей характеризуется константой гидролиза Кг и степенью гидролиза h. Константа гидролиза КГ – характеристика равновесия реакции гидролиза. Степень гидролиза – доля частиц, подвергшихся гидролизу. Например, в случае гидролиза сульфида натрия Na2S:
Константа гидролиз связана с ионным произведением воды и соответствующей константой диссоциации слабого электролита. В случае гидролиза сульфида натрия: Поскольку Степень гидролиза h связана с константой гидролиза КГ и молярностью раствора соли:
Гидролиз усиливается:
Взаимное усиление гидролиза При взаимодействии растворов двух солей, первая из которых подвергается гидролизу по катиону (соль слабого основания), а вторая гидролизу по аниону (соль слабой кислоты), происходит взаимное усиление гидролиза. Такой процесс идет до конца (необратимо) с образованием слабой кислоты и слабого основания из-за взаимодействия протонов и гидроксидных анионов, образующихся в каждом растворе: 2AlCl3 + 3Na2CO3 + 6H2O = 2Al(OH)3↓ + 3CO2↑+ 6NaCl
H+ + OH– = H2O Буферные растворы
|
||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 191; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.153.38 (0.011 с.) |





 H2O + H2O H3O+ + OH–
H2O + H2O H3O+ + OH–
 (1) H3PO4 H+ + H2PO4-
(1) H3PO4 H+ + H2PO4- 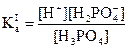
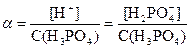

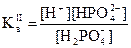


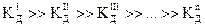 ; следовательно, диссоциация практически останавливается на первой ступени.
; следовательно, диссоциация практически останавливается на первой ступени.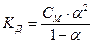
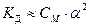 – закон разбавления Оствальда, показывает зависимость степени диссоциации α от концентрации электролита CM.
– закон разбавления Оствальда, показывает зависимость степени диссоциации α от концентрации электролита CM. Н2О Н+ + ОН– К д =
Н2О Н+ + ОН– К д = 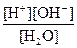 = 1.8∙10–16
= 1.8∙10–16
 NaNO2 + H2O HNO2 + NaOH (молекулярный вид)
NaNO2 + H2O HNO2 + NaOH (молекулярный вид)
 NO2– + H2O HNO2 + OH– (ионный вид)
NO2– + H2O HNO2 + OH– (ионный вид)
 NH4+ + H2O NH4OH + H+ (ионный вид)
NH4+ + H2O NH4OH + H+ (ионный вид)


 K3PO4 + H2O K2HPO4 + KOH PO43– + H2O HPO42– + OH–
K3PO4 + H2O K2HPO4 + KOH PO43– + H2O HPO42– + OH–


 KH2PO4+ H2O H3PO4 + KOH H2PO4– + H2O H3PO4 + OH–
KH2PO4+ H2O H3PO4 + KOH H2PO4– + H2O H3PO4 + OH–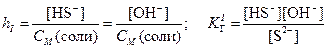
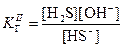
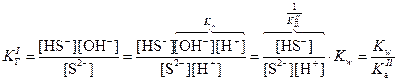
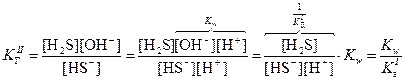
 , поэтому в случае таких солей гидролиз протекает только по I ступени.
, поэтому в случае таких солей гидролиз протекает только по I ступени.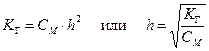 .
.

 Al3+ + H2O AlOH2+ + H+ CO32– + H2O HCO3– + OH–
Al3+ + H2O AlOH2+ + H+ CO32– + H2O HCO3– + OH–


