
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ландшафтно-екологічної практикиСодержание книги
Поиск на нашем сайте
МЕТОДИЧНІ ВКАЗІВКИ до виконання лабораторних робіт при проходженні ЛАНДШАФТНО-ЕКОЛОГІЧНОЇ ПРАКТИКИ (НАДБАННЯ РОБОЧОЇ ПРОФЕСІЇ «ХІМІК-ЛАБОРАНТ») (для студентів 2 курсу денної форми навчання за напрямом підготовки 6.040106 “Екологія, охорона навколишнього середовища та збалансоване природокористування”)
Харків – ХНАМГ – 2011 Методичні вказівки до виконання лабораторних робіт при проходженні ландшафтно-екологічної практики (надбання робочої професії «хімік–лаборант») (для студентів 2 курсу денної форми навчання за напрямом підготовки 6.040106 «Екологія, охорона навколишнього середовища та збалансоване природокористування») / Харк. нац. акад. міськ. госп-ва; уклад.:
Укладачі: О. О. Мураєва, С. В. Волювач, І. С. Зайцева, Т. П. Нат, Т. Д. Панайотова
Рецензент: доц., к.т.н. С. В. Нестеренко
Рекомендовано кафедрою хімії, протокол № 3 від 14.10.09
Передмова Щорічно, літом для студентів, які навчаються на II курсі денного форми навчання екологічного факультету ХНАМГ за напрямом підготовки 6.040106 «Екологія, охорона навколишнього середовища та збалансоване природокористування», проводиться місячна ландшафтно-екологічна практика, 3 неділі з якої відводиться для надбання студентами робочої професії «хімік–лаборант». Практика спрямована на поглиблення теоретичних і практичних знань з дисциплін «Аналітична хімія» та «Фізико–хімічні методи аналізу», що вивчалися в II і III семестрах, а також на придбання і вдосконалення професійних навичок, якими повинен володіти хімік–лаборант, повсякденною роботою якого є визначення і контроль показників якості води, з метою дослідження екологічної безпеки водних об’єктів (струмків, водопровідної, колодязної, річкової, стічної води тощо) міста Харкова та Харківської області. Програма практики передбачає обов'язкове виконання кожним студентом індивідуального завдання з аналізу певного джерела води на придатність її для питних цілей, яке видає й контролює керівник практики. База проходження практики – аналітична лабораторія кафедри хімії ХНАМГ. Тривалість практики – 18 днів, загальна кількість годин на одного викладача – 108. Проведення практики передбачає проведення лабораторних робіт з визначення фізичних, хімічних і токсикологічних показників якості води і самостійної роботи, яка спрямована на ознайомлення і вивчення Держстандартів та іншої нормативної літератури з якості води, виконання розрахункових задач і контрольної роботи, аналізу й оформлення звіту. Логічним завершенням практики є екзамен, за успішного складання якого студент отримує робочу професію «хімік–лаборант», що підтверджується видачею свідоцтва певної форми. Лабораторна робота № 1 Загальні правила роботи і техніка безпеки для працюючих у хімічній лабораторії. Хімічний посуд. Техніка безпеки при роботі з газовими пальниками Підчас використання газових пальників, слід пам’ятати, що газ є отруйною і вибухонебезпечною речовиною. Неправильне й неохайне поводження з газовими пальниками може спричинити отруєння, пожежу, вибух. Потрібно спершу запалити сірник, а потім відкрити кран надходження газу. Слідкуйте за тим, щоб газ не проскочив у середину пальника. Якщо газ або зникає, або стає подовженим і горіння супроводжується свистінням, то це означає, що горіння відбувається всередині гумової трубки, що може привести до її займання. В цьому випадку негайно закрийте кран, зачекайте, поки пальник охолоне, і лише після цього знову запалюйте його, попередньо зменшивши приток повітря. В разі появи запаху газу в лабораторії негайно повідомте про це керівника практики, загасіть вогонь, відчиніть двері й вікна, вийдіть з лабораторії!!! Хімічний посуд В аналітичних лабораторіях найбільш поширене застосування має мірний посуд (мірні й конічні колби, бюретки, піпетки, мірні циліндри, стакани й мензурки тощо), який має певні функції та особливості в роботі. Мірні колби (рис.1) – плоскодонні колби з подовженим, вузьким горлом, на яке нанесена кругова позначка. Об'єм розчину до кругової позначки визначає місткість мірної колби. На практиці використовують мірні колби місткістю 50, 100, 250, 500, 1000 мл. Мірні колби застосовують для приготування розчинів точної концентрації з фіксаналів або за точною наважкою речовини, а також для розбавлення розчинів. У мірних колбах категорично не дозволяється нагрівати й довгий час зберігати розчини, здійснювати хімічні реакції.
Рис.1- Мірні колби При приготуванні розчину мірну колбу потрібно брати тільки за горло і обов’язково вище позначки, щоб не змінити температуру розчина. Розчин або воду наливають до позначки таким чином, щоб вигнутий меніск рідини торкався позначки своєю нижньою частиною. При цьому позначка колби повинна знаходитися точно на рівні очей. Бюретки (рис. 2) – градуйовані скляні трубки, що мають однаковий діаметр по всій довжині. Вони закріплюються вертикально на лабораторному штативі.
Рис.2- Бюретки Правила користування бюретками: 1) бюретку влаштовують у штативі чітко вертикально за допомогою металевих лапок і спеціальних затискувачів; 2) перед початком роботи бюретку через лійку двічі промивають дистильованою водою, потім – робочим розчином, яким будуть титрувати, і тільки потім заповнюють робочим розчином до нульової позначки, контролюючи, щоб не було бульбашок повітря в скляному капілярі; 3) розчин з бюретки при титруванні додавати краплями, не допускаючи витікання струменем. Розчин у колбі, що титрують, обов’язково ретельно перемішувати; 4) при всіх відліках за бюреткою очі спостерігача повинні розташовуватися чітко на рівні меніска рідини.
а б Рис. 3- Піпетки (а – піпетка Мора; б – градуйована піпетка)
У лабораторній практиці застосовують також градуйовані піпетки (рис. 3 б). Це градуйовані циліндричні скляні трубки з відтягнутим кінцем, які мають різні значення ціни поділки. Такі піпетки використовують, як правило, для допоміжних операцій. Правила користування піпетками: 1) піпетка повинна бути чистою; 2) носик піпетку занурюють у стаканчик з розчином і всмоктують його за допомогою резинової груші; 3) як тільки розчин у піпетці підніметься вище позначки, грушу швидко від’єднують від піпетки й швидко затуляють верхній отвір піпетки вказівним пальцем; 4) тримаючи вертикально над стаканчиком піпетку, її встановлюють таким чином, щоб позначка піпетки знаходилася на рівні очей, трохи послаблюють тиск вказівного пальця, щоб розчин почав поступово витікати в стаканчик доти, доки нижній меніск розчину не торкнеться позначки, після чого припиняють витікання розчину; 5) вводять носик піпетки до колби або склянки, куди потрібно перенести порцію розчину (не торкаючись стінок посудини) і зливають розчин; 6) при зливанні всього розчину категорично не дозволяється видувати з кінчика піпетки утримувану капілярними силами краплю розчину, тому що піпетка градуйована на вільний злив. Після того, як розчин стече з піпетки, торкаються піпеткою до горла колби (склянки) і ще 5–10 сек. чекають.
Рис. 4– Конічні колби
Рис. 5– Мірні циліндри Рис.6– Мензурка Хімічні стакани (рис. 7) бувають різної ємкості (від 50 до 1000 мл), іх використовуються для допоміжних робіт з водними розчинами й органічними рідинами. Крапельниці (рис. 8) використовують для дозування індикаторів і повільного додавання реагенту до реакційної суміші.
Рис.7– Хімічні стакани Рис. 8– Крапельниця Рис. 9– Бюкс Рис.10– Лійка
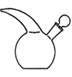
Рис. 11– Промивалка Рис. 12– Ексикатор Рис.13– Кристалізатор Бюкс – стаканчик з притертою пробкою (рис. 9) використовують для зважування, висушування і зберігання речовин. Лійка лабораторна ( рис. 10) використовують для переливання рідин або їх фільтрування крізь паперові фільтри. Промивалка (рис.11) призначена для промивання осадів, посуду й приготування розчинів. Ексикатор (рис.12) - посуд, у якому підтримують певну вологість повітря (звичайно близьку до нуля), виготовлений з товстого скла. Використовують для повільного висушування за кімнатної температури й зберігання гігроскопічних сполук. Кристалізатор (рис. 13) – тонкостінний плоскодонний скляний посуд для перекристалізації речовин; застосовують у лабораторній практиці. Миття хімічного посуду Хімічний посуд перед проведенням дослідів обов’язково необхідно ретельно вимити. Посуд вважається чистим, якщо після виливання з нього води на внутрішній поверхні посуду не залишається крапель. Новий або мало забруднений посуд достатньо вимити водою з додаванням до неї будь-якого миючого засобу, промити декілька разів водопровідною водою і ополоснути дистильованою водою. Для миття забрудненого скляного посуду використовують наступні миючі засоби: 1. Розчин соди 2. Хромова суміш – дуже ефективний миючий розчин. Рецептів приготування хромової суміші багато, наприклад: дихромат калію – 60 г, концентрована сульфатна кислота 80 мл, вода – 270 мл). Забруднений посуд заповнюють на Сушити скляний посуд потрібно не завжди. Вимитий посуд часто достатньо перевернути до гори дном і дати воді збігти. Хімічний посуд ніколи не витирають рушником зсередини. В разі потреби висушування скляного посуду, це роблять у сушильній шафі (окрім мірного посуду, котрий забороняється висушувати нагріванням). Використовувативисушений в шафі посуд можна тільки після повного його остигання і прийняття температури приміщення. Лабораторна робота № 2 Головні умови відбору проб: · проба або серія проб, відібраних для аналізу, повинна бути характерною для даного природного об'єкта в місці їх відбору; · відбір проб, їх транспортування, зберігання та подальша обробка повинні виконуватись так, щоб не змінювався вміст інгредієнта або групи інгредієнтів, які визначають; · об'єм або маса проби повинні повністю забезпечити можливість виконання запланованих аналітичних визначень. Посуд для відбору проб води Проби відбирають у хімічно чистий посуд з притертими пробками (допускаються коркові й поліетиленові пробки), виготовлений з міцного, безкольорового хімічно-стійкого скла або в поліетиленовий посуд, дозволений для контакту з питною водою. Для відбору проб з великих глибин використовують спеціальні прилади–батометри.
Відбір проб води з криниць Якщо в криниці є насос, то воду відкачують протягом 15 хв. і лише після цього беруть пробу. Якщо насоса немає, то пробу беруть з середньої частини водяного стовпа. Лабораторна робота № 3 Робота в лабораторії Посуд: 1. Колба плоскодонна з притертою пробкою місткістю 250-350 мл. 2. Скло годинникове. 3. Баня водяна. Сутність методу визначення запаху води. Характер та інтенсивність запаху визначають органолептичним методом. Характер запаху води визначають відчуттям сприйнятого запаху (землистий, хлорний, нафтопродуктів тощо). Методика визначення Запах питної води визначають відповідно до ГОСТ 3351-74. Проби води відбирають відповідно до ГОСТ 4979–49 і 2874–82 об’ємами не менше 500 мл. Проби не консервують і визначення проводять не пізніше, ніж через 2 години після відбору. Визначення запаху води здійснюють при температурі При Для визначення запаху при Інтенсивність запаху води, визначають при Таблиця 3.1. Інтенсивність запаху
Робота в лабораторії При лади, посуд і реактиви: 1. Фотоелектроколориметр ФЕК–72 з синім світлофільтром ( 2. Кювети товщиною 5-10 см. 3. Циліндр Неслера місткістю 100 мл – 12 шт. 4. Фільтр мембранний №4. 5. Піпетки мірні, ємністю 1, 5, 10 см3. 6. Головний стандартний розчин 7. Розведений розчин Кольоровість води зумовлена, головним чином, розчиненими гуміновими речовинами, колоїдними сполуками заліза, масовим розвитком водоростей. Кольоровість води можна визначити двома методами – візуальним (за дихроматно - кобальтовою шкалою) або фотометричним. Робота в лабораторії Прилади, посуд і реактиви: 1. Фотоелектроколориметр ФЕК- 72 с зеленим світлофільтром ( 2. Кювети з товщиною 5-10 см. 3. Піпетки мірні місткістю 1,5,10,25 і 100 мл. 4. Циліндр мірний місткістю 100 мл – 12 шт. 5. Каолін збагачений для парфумерної промисловості (ГОСТ 21285), або для кабельної промисловості (ГОСТ 21288). 6. Пірофосфат калію 7. Насичений розчин хлорної ртуті
Загальні відомості Каламутність води зумовлюється наявністю в ній завислих частинок піску, глини, органічних і неорганічних колоїдних речовин, фіто– і зоопланктону. Причиною каламутності є мули, гідроксиди алюмінію та заліза, силіцієва кислота, планктони тощо. Каламутність води визначають згідно з ГОСТ 3351-74 не пізніше, ніж через 24 години після відбору проби. Проби води відбирають за ГОСТ4979-49 і 2474-82.
С утність методу. Каламутність води визначають фотометричним методом шляхом порівняння каламутності проби води, яку досліджують з каламутністю робочих стандартних суспензій. Метод базується на можливості використання закону Бугера-Ламберта-Бера для безкольорових суспензій або білих золів, коли зменшення інтенсивності світла, яке пройшло, обумовлено домінуючим впливом опалесценції (світлорозсіювання) від завислих часток, тоді як у кольорових розчинах домінуючий вплив має поглинання світла. Пристосованість закону Бугера-Ламберта-Бера для безкольорових суспензій перевіряють графічно: залежність оптичної густини від концентрації завислих речовин повинна бути лінійною. Фотометричний метод використовують лише при концентрації зависей менших за 100 мг/л, при більшому вмісті їх визначають гравіметричним методом, фільтруючи воду крізь беззольні паперові фільтри "синя стрічка" або мембранні фільтри.
Методика визначення Лабораторна робота 4 Визначення рН води потенціометричним методом Самостійна підготовка Проробити такі питання: 1. До якого типу електродів відноситься скляний електрод? Які в нього недоліки і переваги? 2. Поясніть механізм виникнення стрибка потенціалу на межі скло – розчин. 3. Як готують електрод до роботи? 4. У чому сутність калібрування скляного електрода. Чим зумовлена необхідність цієї процедури? 5. Напишіть схему гальванічного елемента, що застосовують для вимірювання рН? 6. Яка будова хлоридсрібного електроду? До електродів якого типу він відноситься? Чому саме цей електрод застосовують як електрод порівняння? Експериментальна частина Реагенти, посуд і апаратура 1. Іономер І-160 М. 2. Скляний електрод ЕСЛ–43-07. 3. Хлоридсрібний електрод ЕВЛ–1М3.1 Підготовку електродів до роботи здійснюють згідно з правилами, наведеними в паспортах до електродів. 4. Буферні розчини– стандарт титри: – 0,05 m розчин гідрофталату калію ( – 0,025 m розчин дигідрофосфату калію та 0,025 m розчин гідрофосфату натрію ( – 0,01 m розчин тетраборату натрію ( Готувати буферні розчини необхідно на звільненій від вуглекислоти дистильованій воді. Буферні розчини зберігають у герметичному скляному або поліетиленовому посуді. Термін зберігання фосфатного буферу – 2 міс., решти – 3 міс. 5. Стаканчик місткістю 100 мл. 6. Хлорид калію, хч, насичений розчин. 7. Кислота хлоридна, 0,1М розчин.
Мета роботи: 1. Освоїти принципи й техніку прямих потенціометричних визначень і роботу зі скляним електродом. 2. Визначити Лабораторний іономір І-160 М призначений для прямого і непрямого потенціометричного вимірювання активності іонів водню (pХ), активності й концентрації інших одновалентних і двовалентних аніонів і катіонів (pХ ), окисно-відновних потенціалів (Eh) і температури у водних розчинах з поданням результатів у цифровій формі й у вигляді аналогового сигналу напруги постійного струму. За допомогою цього іономіру, використовуючи різні іон-селективні електроди, можна визначати вміст багатьох іонів, наприклад При визначенні рН досліджуваної води прямою потенціометрією, за допомогою іономеру І–160 М можна діяти двома способами: 1. Для декількох буферних розчинів з відомими значеннями рН виміряють Е і будують градуювальний графік у координатах Е– рН. Далі виміряють Е проби води, що аналізують, і за градуювальним графіком знаходять рН. 2. При масових визначеннях достатньо надійно відкалібрувати прилад за двома буферними розчинами з відомими значеннями Визначення рН води проводять одразу після відбору проби для запобігання хімічних і біохімічних процесів, що можуть привести до суттєвої зміни рН води. Для визначення рН використовують гальванічний елемент, який складають з індикаторного скляного електрода (ЕСЛ –43–07), потенціал якого є функцією концентрації іонів
Порядок роботи на іономірі при визначенні
1. Перед початком роботи прилад необхідно ввімкнути й прогріти протягом 30 хв. 2. Для проведення вимірів вимірювальний (скляний) і допоміжний (хлоридсрібний) електроди встановити на штатив і підключити відповідно до гнізд «ИЗМ.» і «ВСП.» приладу. 3. Вибір каналу вимірювання (іономір має 9 каналів). Натисканням кнопок ◄ або ► встановити курсор на цифру, що позначає номер каналу. Кнопками ▲ або ▼ вибрати номер каналу. Натиснути кнопку «ВВОД».
4. Робота в режимі «УСТАНОВКА» 4.1. Натисканням кнопки «РЕЖИМ» вибрати режим «УСТАНОВКА», натиснути кнопку «ВВОД». У режимі «УСТАНОВКА» необхідно: 4.1.1. Вибрати «Вид ионов» ( 4.1.2. Вибрати одиниці вимірювання «Размерность» (рХ). Після вибору натисніть кнопку «ВВОД». 4.1.3. Перевірити координати ізопотенціальної точки скляного електрода (рНі і Еі). На дисплеї д ля електроду ЕСЛ-43-07 повинні з’явитися координати ізопотенціальної точки: рНі = 7; Еі = – 25 мВ. Допустима похибка відхилення рН в ізопотенціальній точці Після перевірки значень координат ізопотенціальної точки натисніть кнопку «ВВОД». 5. Робота в режимі «НАСТРОЙКА» 5.1. Натисканням кнопки «Режим» вибрати режим «НАСТРОЙКА» і натиснути кнопку «ВВОД». Для настройкивикористовують 3 контрольних буферних розчина з відомими значеннями рН. При цьому доцільно вибирати буферні розчини таким чином, щоб з рН, близьким до рН досліджуваної води. Перед кожним занурюванням електродів у буферний розчин або пробу води обов’язково необхідно робочі частини електродів промити дистильованою водою, а залишки крапель води обережно видалити (без тертя) фільтрувальним папером!! 5.2. Настройка за першим буферним розчином (рН=6,86). 5.2.1. Занурити електроди й термометр у перший буферний розчин таким чином, щоб робочі частини електродів не торкалися один одного, стінок і дна стаканчика. Кулька скляного й носик хлоридсрібного електродів обов’язково повинні знаходитися під поверхнею рідини. 5.2.2. Установка температури розчинів. Іономір може працювати при автоматичній («Та) або ручній («Тр») установці температури. Ручну установка використовують при постійній температурі розчинів. Для ручної установки температури необхідно: натисканням кнопки ► перемістити курсор у поле значення наявної температури, що показує термометр. Ввести необхідне значення температури, використовуючи кнопки ▲,▼,◄,►і натиснути кнопку «ВВОД». 5.2.3. Дочекатися встановлення стабільного значення температури і Е (ЕРС) у правому верхньому куті приладу (не менше 3 хв.). При цьому на дисплеї виводиться значення рН першого буферного розчину. Якщо визначене приладом рН співпадає з теоретичним значенням рН буферного розчину, то натискають кнопку «ВВОД»; Якщо визначене приладом рН не співпадає з теоретичним значенням рН буферного розчину, то необхідно відкорегувати значення рН, котре виводиться на дисплей, використовуючи кнопки ▲,▼,◄,►, після чого натиснути кнопку «ВВОД». Прилад запропонує провести настройку за другим буферним розчином. 5.3. Настройка за другим буферним розчином проводять згідно з пунктами (5.2.1–5.2.3). Увага! Якщо в процесі настройки за двома розчинами в правому нижньому куті дисплея з'явиться повідомлення К s < 0,8 або Ks > 1,2 (де К s – поправочний коефіцієнт, який враховує відхилення реальної крутизни електродної функції від теоретичного значення), необхідно замінити буферні розчини й повторити настройку! Якщо повідомлення повториться, необхідно замінити електроди! 6. Робота в режимі «ИЗМЕРЕНИЕ» Натисканням кнопки «РЕЖИМ» вибрати «ЗАКОНЧИТЬ» настройку і прилад автоматично перейде в режим «ИЗМЕРЕНИЕ», після чого необхідно: 1) виконати контроль правильності проведення настройки за третім 2) виконати вимірювання рН проби води. Лабораторна робота № 5 Метод нейтралізації. Приготування і стандартизація робочих розчинів Самостійна підготовка Проробити такі питання: 1. У чому суть методу нейтралізації, які реакції лежать у його основі? 2. Які речовини можна визначити методом нейтралізації і чому? Наведіть приклади. 3. Які робочі розчини використовують у методі нейтралізації? Якої концентрації їх готують і чому? 4. Які речовини використовують як вихідні, які вимоги до них ставляться? 5. Які індикатори використовують у методі нейтралізації? Що таке інтервал переходу й показник титрування індикатора? 6. На чому ґрунтується вибір індикатора, яке значення при цьому має стрибок рН на кривій титрування? Робота в лабораторії Посуд і реактиви 1. Хлоридна кислота 2. Хлоридна кислота (фіксанал). 3. Тетраборат натрію Na 2 B 4 O 7 × 10 H 2 O (бура). 4. Гідроксид натрію 5. Індикатори: метиловий жовтогарячий і фенолфталеїн – 0,1%-ні розчини. 6. Бюретка місткістю 25 мл. 7. Колби мірні (250, 500, 1000 мл). 8. Конічна колба місткістю 250 мл. 9. Піпетки місткістю 10, 20 мл. Хід визначення: 1.Приготований розчин х лоридної кислоти наливають через лійку в ретельно вимиту бюретку, яку перед тим ополіскують невеликими порціями розчину, для виведення залишків води, вище нульової позначки. Заповнюють розчином носик бюретки, витиснувши з нього повітряні бульбашки. Потім знімають лійку і встановлюють нижній край меніска розчину хлоридної кислоти на нульовій позначці. 2. Виконуючи всі правила, переносять піпеткою, яку двічі ополіскують розчином бури, в чисту конічну колбу 10 або 20 мл розчину бури, не видуваючи останню краплю з піпетки, а знімаючи її дотиком кінця піпетки до внутрішньої стінки колби для титрування, додають 2 – 3 краплини метилового жовтогарячого, після чого колбу підставляють під бюретку таким чином, щоб кінець бюретки ввійшов у колбу на 1 – 2 см, і починають титрування, поклавши заздалегідь під колбу білий аркуш паперу. Титрування проводять, підтримуючи колбу правою рукою, а лівою, відкриваючи кран бюретки, обережно невеликими порціями доливають хлоридну кислоту, при цьому вміст колби безперервно перемішують плавними обертальними рухами. Титрування вважають закінченим у той момент, коли забарвлення індикатора в розчині перейде (від додавання однієї краплі хлоридної кислоти) з жовтого в жовтогаряче (рН=4). Під час титрування зручно користуватися ”свідком”. Для цього в окрему колбу відміряють циліндром 50 мл дистильованої води, додають 1 – 2 краплини, метилового жовтогарячого, а з бюретки – 1 краплину розчину хлоридної кислоти. Розчин повинен мати помітне жовтогаряче забарвлення. При користуванні “свідком” титрування закінчують, коли розчин прийме колір “свідка”. Визначають за бюреткою (з точністю до сотих мілілітра) об’єм розчину кислоти, витраченої на титрування і занотовують дані в журнал. Титрування повторюють кілька разів до отримання не менше, ніж трьох результатів, що відрізняються не більше, як на 0,1 мл, причому кожного разу рівень розчину в бюретці треба встановлювати на нуль, а при відліку стежити за тим, щоб око було на рівні меніску. Отримані результати занотовують у вигляді таблиці:
Знаходять середнє значення об’ємів хлоридної кислоти, витрачених на титрування, враховуючи тільки результати, що сходяться, і визначають її концентрацію із співвідношення: де
Отже остаточно
5.3.2. Приготування і стандартизація ~ 0,1 М робочого розчину лугу У методі нейтралізації в якості розчинів лугів використовують зазвичай 0,1 М розчин гідроксиду натрію. Оскільки NaOH е нергійно реагує з СО2 повітря, утворюючи на поверхні реактиву карбонати, та є гігроскопічним, то його розчин готують швидко, за приблизною наважкою. а) Приготування ~ 0,1 М розчину NaOH за наважкою Для приготування 1 л 0,1 М розчину гідроксиду натрію наважка NaOH повинна бути 4 г ( б) Приготування робочого ~0,1 М розчину NaOH методом розведення з 1 М розчину NaOH 1М розчин NaOH готують заздалегідь, виходячи з того, що для приготування, наприклад 1 л цього розчину потрібна наважка: Наважку беруть більшу (до 50 г), швидко зважуючи її на технічних вагах. Наважку вміщують у склянку, швидко ополіскують 2 – 3 рази малими порціями води. Промитий їдкий натр вміщують у калібровану на 1 л колбу і готують розчин. Спочатку слід долити невелику кількість води, а коли реактив розчиниться, дають розчинові охолонути і доводять об’єм розчину до позначки 1 л. Отриманий ~ 1М розчин є вихідним для подальшої роботи студентів. | |||||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |




 В нижній частині бюретки мають скляний кран або гумову трубку зі скляною кулькою (або затискувачем), які з’єднані зі скляним капіляром для витоку розчину. Бюретки призначені для титрування або для вимірювання невеликих об’ємів розчинів у серійних аналізах. Найчастіше використовують бюретки місткістю 25, 50 мл з ціною поділки 0,1 мл. Таким чином, можна за допомогою бюретки виміряти об’єм з точністю до 0,03 мл, умовно поділяючи одну поділку бюретки на три частини.
В нижній частині бюретки мають скляний кран або гумову трубку зі скляною кулькою (або затискувачем), які з’єднані зі скляним капіляром для витоку розчину. Бюретки призначені для титрування або для вимірювання невеликих об’ємів розчинів у серійних аналізах. Найчастіше використовують бюретки місткістю 25, 50 мл з ціною поділки 0,1 мл. Таким чином, можна за допомогою бюретки виміряти об’єм з точністю до 0,03 мл, умовно поділяючи одну поділку бюретки на три частини.
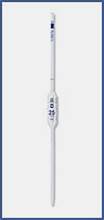 Піпетки – скляні трубки з розширенням у середній частині – «піпетки з кулькою – піпетки Мора » (рис.3 а). У верхній частині піпетки є одна кругова позначка, яка визначає її місткість (10, 25,50,100 мл), а її нижня частина витягнута в капіляр («носик» піпетки). Піпетка такої форми призначена для точного відбору проб розчинів певного об'єму (аліквот).
Піпетки – скляні трубки з розширенням у середній частині – «піпетки з кулькою – піпетки Мора » (рис.3 а). У верхній частині піпетки є одна кругова позначка, яка визначає її місткість (10, 25,50,100 мл), а її нижня частина витягнута в капіляр («носик» піпетки). Піпетка такої форми призначена для точного відбору проб розчинів певного об'єму (аліквот). Конічні колби (рис. 4) – плоскодонні конічні колбимісткістю 200–500 мл. Ці колби завжди використовують при титруванні. В них вміщують піпеткою певний об’єм проб води або інших розчинів.
Конічні колби (рис. 4) – плоскодонні конічні колбимісткістю 200–500 мл. Ці колби завжди використовують при титруванні. В них вміщують піпеткою певний об’єм проб води або інших розчинів. Мірні градуйовані циліндри (рис.5 ) й мензурки (рис.6) використовуються для
Мірні градуйовані циліндри (рис.5 ) й мензурки (рис.6) використовуються для  грубого відмірювання об'єму рідини, існують різної ємкості: 5, 10, 25, 50, 100, 150, 250, 500, 1000 і 2000 мл.
грубого відмірювання об'єму рідини, існують різної ємкості: 5, 10, 25, 50, 100, 150, 250, 500, 1000 і 2000 мл.




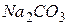 . Рекомендують використовувати гарячий 30–40 % розчин
. Рекомендують використовувати гарячий 30–40 % розчин 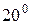 і
і 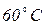 .
.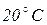 в колбу з притертою пробкою місткістю 250–350 мл вміщують 100 мл води, яку досліджують. Колбу закривають пробкою і кілька разів перемішують обертальними рухами, після чого колбу відкривають і визначають характер та інтенсивність запаху.
в колбу з притертою пробкою місткістю 250–350 мл вміщують 100 мл води, яку досліджують. Колбу закривають пробкою і кілька разів перемішують обертальними рухами, після чого колбу відкривають і визначають характер та інтенсивність запаху.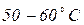 , перемішують воду і, зсунувши скло вбік, швидко визначають характер і інтенсивність запаху.
, перемішують воду і, зсунувши скло вбік, швидко визначають характер і інтенсивність запаху.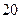 і
і 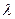 = 413 нм).
= 413 нм).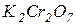 і
і 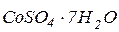 (розчин № 1)- готують розчиненням 0,0875 г двохромовокислого калію (
(розчин № 1)- готують розчиненням 0,0875 г двохромовокислого калію (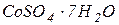 ) і 1 мл концентрованої сульфатної кислоти (
) і 1 мл концентрованої сульфатної кислоти (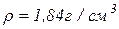 ) в дистильованій воді з доведенням об’єму розчину до 1 л. Такий розчин відповідає кольоровості 500
) в дистильованій воді з доведенням об’єму розчину до 1 л. Такий розчин відповідає кольоровості 500 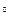 .
. (розчин № 2) - готують розчиненням 1 мл концентрованої сульфатної кислоти (
(розчин № 2) - готують розчиненням 1 мл концентрованої сульфатної кислоти (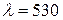 нм).
нм).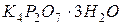 або натрію
або натрію 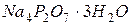
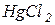 .
.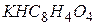 ), рН= 4,01;
), рН= 4,01;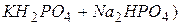 , рН=6,86;
, рН=6,86;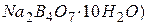 , рН=9,18.
, рН=9,18.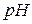 проб води за допомогою іономіра лабораторного І -160 М.
проб води за допомогою іономіра лабораторного І -160 М. 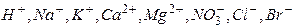 тощо.
тощо.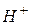 у розчині, та електрода порівняння (хлоридсрібний ЕВЛ-1М3.1), потенціал якого є сталим і не залежить від концентрації іонів
у розчині, та електрода порівняння (хлоридсрібний ЕВЛ-1М3.1), потенціал якого є сталим і не залежить від концентрації іонів 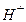 ,
, 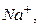
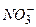 тощо). При вимірюванні рН слід вибрати
тощо). При вимірюванні рН слід вибрати  рН= ± 0,3 іЕ= ± 25 мВ.
рН= ± 0,3 іЕ= ± 25 мВ.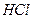 (конц.).
(конц.).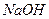 (ч.д.а.).
(ч.д.а.).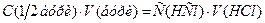 ,
,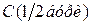 – молярна концентрація еквівалента бури, моль/л;
– молярна концентрація еквівалента бури, моль/л;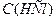 – молярна концентрація хлоридної кислоти, моль/л;
– молярна концентрація хлоридної кислоти, моль/л;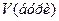 і
і 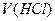 – об’єми відповідних розчинів, мл.
– об’єми відповідних розчинів, мл.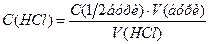 , моль/л.
, моль/л.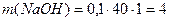 г), але замість розрахованих 4 г NaOH беруть 5–6 г. Наважку зважують швидко на технохімічних вагах у закритому бюксі. Після чого висипають її в склянку і ополіскують 2–3 раза малими порціями води. Промитий їдкий натр вміщують у калібровану на 1 л колбу, доливають невелику кількість води, а коли реактив повністю розчиниться, дають розчину охолонути і доводять об’єм розчину дистильованою водою до позначки. Ретельно перемішують і переливають у чисту склянку. Наносять маркування (концентрація, дата).
г), але замість розрахованих 4 г NaOH беруть 5–6 г. Наважку зважують швидко на технохімічних вагах у закритому бюксі. Після чого висипають її в склянку і ополіскують 2–3 раза малими порціями води. Промитий їдкий натр вміщують у калібровану на 1 л колбу, доливають невелику кількість води, а коли реактив повністю розчиниться, дають розчину охолонути і доводять об’єм розчину дистильованою водою до позначки. Ретельно перемішують і переливають у чисту склянку. Наносять маркування (концентрація, дата).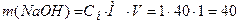 г.
г.


