
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розрахунок вмісту іонів натрію у пробі воді (мг/л)Содержание книги
Поиск на нашем сайте Визначене значення Виходячи з того, що Оскільки відомо, що Вміст іонів натрію Х (мг/л) розраховують за формулою
де 23 - молярна маса іону натрію (г/моль).
Лабораторна робота № 15 Визначення перманганатної окисності води методом Кубеля Проробити такі питання: 1. Перманганатометрія. Сутність методу. Робочі розчини метода. Фактори еквівалентності окисників і відновників. Окисно–відновні потенціали. Вплив рН на окислювальні властивості 2. Що таке окисність води? Що таке часткова й повна, перманганатна й дихроматна окисність води? 3. В яких одиницях вимірюють окисність води? 4. Яка окисність джерельної, артезіанської і річкової води? Яка окисність питної води? 5. Чому перманганатом калію неможливо визначити повну окисність води? 6. У чому сутність метода Кубеля при визначенні перманганатної окисності води?
Загальні положення Перманганатна окисність води характеризує загальний вміст у природній воді органічних відновників, що легко окислюються. Перманганатна окисність води вимірюється числом міліграмів атомарного кисню або Визначенню окисності заважають іони 1 мг 1 мг 1 мг Робота в лабораторії Посуд, реактиви 1. Колба мірна ємкістю 1 л. 2. Циліндр мірний ємкістю 25 мл. 3. Бюретка ємкістю 25 мл. 4. Піпетка ємкістю 100 мл. 5. Лійка. 6. Конічні колби ємкістю 200–250 мл. 7. Перманганат калію 8. Оксалатна кислота 9. Розбавлений розчин 10. Концентрований розчин KMnO4, підкислений 11. Концентрований розчин HCl. 12. Скляні кульки або капіляри.
15.2. Приготування і стандартизація ~ 0,01 н. розчину
Для виконання роботи необхідно: а) приготувати приблизно 0,01н. робочий розчин KMnO 4 (готується заздалегідь); б) приготувати стандартний 0,01н. розчин оксалатної кислоти; в) визначити точну концентрацію розчину KMnO 4 за розчином оксалатної кислоти. 15.2.1. Приготування приблизно 0,01н. розчину Кристалічний
15.2.2. Приготування 0,01н. розчину Якщо 0,01н. розчин оксалатної кислоти неможливо приготувати з фіксаналу, то його готують за точною наважкою після очищення оксалатної кислоти перекристалізацією. Приготовлений розчин зберігають у темному місці, бо інакше оксалатна кислота поступово розкладається і довго зберігатися не може. Для підвищення терміну зберігання розчину до нього додають 300 мл розбавленої 15.2.3. Стандартизація ~0,01 н. розчину Визначення точної концентрації (стандартизацію) приготовленого приблизно 0,01н. розчину Заповнюють бюретку до верхнього меніску робочим розчином Отриманий гарячий розчин оксалатної кислоти титрують ~ 0,01 н. розчином
(методом напівреакції розставити коефіцієнти). Титрування з результатами, що збігаються і відрізняються не більше ніж на 0,1 мл, повторюють тричі; об’єм розчину KMnO4, що пішов на титрування, занотовують до журналу, визначають середнє значення цього об’єму і обчислюють молярну концентрацію еквівалента перманганату калію в розчині за формулою де
|
||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 120; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.006 с.) |

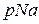 для проби води, що досліджують, занотовують до табл. 14.1.
для проби води, що досліджують, занотовують до табл. 14.1.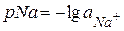 методом потенціювання визначають значення активності іонів натрію як
методом потенціювання визначають значення активності іонів натрію як 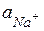 =
= 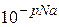 (у моль/л).
(у моль/л).
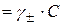 , то для знаходження
, то для знаходження 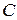 (моль/л)спочатку необхідно знайти коефіцієнти активності іонів натрію (g±) в досліджуваній воді. Для цього за даними табл. 14.1 будують графік залежності
(моль/л)спочатку необхідно знайти коефіцієнти активності іонів натрію (g±) в досліджуваній воді. Для цього за даними табл. 14.1 будують графік залежності  і за ним знаходять коефіцієнт активності іонів натрію.
і за ним знаходять коефіцієнт активності іонів натрію.
 ,
,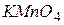 .Умови проведення перманганатометричного титрування. Використання перманганатометрії в аналізі води.
.Умови проведення перманганатометричного титрування. Використання перманганатометрії в аналізі води. і
і 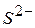 . Їх визначають окремо, перераховують на кисень, який іде на їхнє окислення (мг О/л), і віднімають від перманганатної окисності. Доведено, що
. Їх визначають окремо, перераховують на кисень, який іде на їхнє окислення (мг О/л), і віднімають від перманганатної окисності. Доведено, що відповідає 0,47 мг спожитого кисню
відповідає 0,47 мг спожитого кисню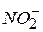 – 0,35 мг
– 0,35 мг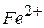 – 0,14 мг.
– 0,14 мг. (к.) або фіксанал.
(к.) або фіксанал. (1:3). Додають при збовтуванні 1 об’єм концентрованої сульфатної кислоти
(1:3). Додають при збовтуванні 1 об’єм концентрованої сульфатної кислоти 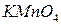 (
(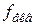 = 1/5)
= 1/5)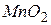 . Окрім того, концентрація розчину
. Окрім того, концентрація розчину 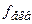 = 1/5) за точною наважкою неможливо. Тому його готують швидко, за приблизною наважкою, трохи більшою за необхідну. Для приготування 1 л 0,01н. розчину
= 1/5) за точною наважкою неможливо. Тому його готують швидко, за приблизною наважкою, трохи більшою за необхідну. Для приготування 1 л 0,01н. розчину  (
(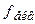 = 1/2)
= 1/2)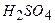 (1:5) на 1 л розчину.
(1:5) на 1 л розчину.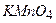 (
( (
( і нагрівають до 80–900С, ні в якому разі не доводячи до кипіння, бо оксалатна кислота розкладається при кип’ятінні.
і нагрівають до 80–900С, ні в якому разі не доводячи до кипіння, бо оксалатна кислота розкладається при кип’ятінні.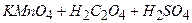 →
→ 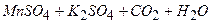
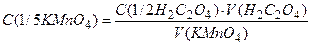 ,
,  – молярна концентрація еквівалента
– молярна концентрація еквівалента  – молярна концентрація еквівалента
– молярна концентрація еквівалента  у розчині, моль/л;
у розчині, моль/л; 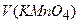 – об’єм розчину
– об’єм розчину 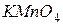 , що пішов на титрування, мл;
, що пішов на титрування, мл;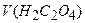 – об’єм розчину оксалатної кислоти, взятий для титрування, мл.
– об’єм розчину оксалатної кислоти, взятий для титрування, мл.


