
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення вмісту розчиненого у воді кисню методом Вінклера
Проробити такі питання: 1. Джерела потрапляння кисню до природної води. 2. Значення розчиненого кисню для життя вищих організмів у воді. 3. Від яких факторів залежить концентрація у воді розчиненого кисню? 4. Сутність йодометричного методу визначення розчиненого кисню. Які робочі розчини застосовують для його визначення? 5. Назвіть умови, додержування яких є обов’язковим при йодометричних визначеннях. 6. Як характеризує розчинний кисень якість природних вод? 7. В яких одиницях виражають кількість розчиненого кисню у воді? Загальні положення Кисень є одним з найважливіших розчинених газів, постійно присутніх у поверхневих водах. Вміст кисню значною мірою визначає хіміко-біологічний стан природних вод, впливає на величину окисно-відновного потенціалу, а отже зумовлює напрямок і швидкість процесів хімічного й біохімічного окиснювання органічних і неорганічних сполук. Головними джерелами надходження кисню в поверхневі води є процеси абсорбції його з атмосфери й продуціювання рослинами в процесі фотосинтезу. Споживання кисню у воді пов'язане з хімічними та біохімічними процесами окиснювання органічних і деяких неорганічних речовин ( Таким чином, вміст розчиненого кисню є важливим параметром оцінки якості санітарного стану водойм. Зниження його вмісту вказує на різку зміну біохімічних процесів у водоймі, на появу речовин–забруднювачів, що інтенсивно окиснюються киснем.
Робота в лабораторії
Посуд, приладдя, реактиви: 1. Терези аналітичні. 2. Бюкси, лійки, мірні колби ємкістю 200 – 250 мл. 3. Бюретки ємкістю 25 мл. 4. Піпетки ємкістю 15 – 20 мл. 5. Колби конічні для титрування. 6. ~0,02 н. розчин 7. 0,02н. розчин 8. 2н. розчин сульфатної кислоти. 9. 20%-вий розчин КІ. 10. 0,5%-вий розчин крохмалю.
Для виконання роботи необхідно: 1. Приготувати 0,02 н. робочі розчини: а) 2. Відстандартизувати приготовлений розчин 3. Визначити вміст розчиненого кисню у воді, що досліджують.
16.1.1. Приготування робочого ~ 0,02 н. розчину тіосульфату натрію Розчин тіосульфату натрію а також достатньо легко окиснюється киснем повітря: Для попередження цих небажаних реакцій бідистильовану воду, з якої готують розчин, обов’язково кип’ятять для видалення
Для приготування 1л ~ 0,02 н. розчину тіосульфату натрію розраховують наважку
Приготувати розчин тіосульфату натрію за точною наважкою неможливо, внаслідок реакцій (16.1 і 16.2). Тому цей розчин готують швидко, за приблизною наважкою, переливають у темну склянку і залишають стояти 7–10 діб. Для підвищення стійкості зберігання отриманого розчину до нього рекомендують додати 0,1 г 16.1.2. Приготування стандартного 0,02Н розчину 1 л 0,02 н. розчин
16.1.3. Стандартизація приготовленого робочого розчину Перед роботою розчин
Вільний йод, який утворився в еквівалентній кількості до вмісту
Отже, це замісне титрування, яке ґрунтується на співвідношенні: тоді, вочевидь, концентрацію розчину
Методика встановлення концентрації робочого розчину Наповнюють бюретку розчином Перевіряють точність титрування. Для цього до відтитрованого розчину додають одну краплину 0,02 н. розчину Визначення повторюють кілька разів до отримання не менше, ніж три подібних результата, що різняться не більше як на 0,1 мл. Знаходять середнє значення об’єму й нормальну концентрацію.
|
||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 218; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.219.166 (0.01 с.) |
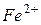 ,
, 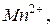
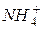 ,
, 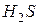 , CH4 тощо), що містяться у воді, а також з диханням водних організмів. Швидкість споживання кисню збільшується з підвищенням температури, кількості бактерій та інших водних організмів і речовин, що піддаються хімічному і біохімічному окиснюванню. Залежно від ступеня забрудненості поверхневих вод, вміст розчиненого кисню може коливатися від 0 до 14 мг/л. Добові коливання в основному залежать від співвідношення інтенсивності процесів його продуціювання й споживання, і можуть досягати 2–3 мг/л розчиненого кисню. Вміст кисню у воді впливає на життєдіяльність фауни й флори водойм. Наприклад, мінімальний вміст розчиненого кисню, що забезпечує нормальний розвиток риб, становить близько 5 мг/л. Зниження його до 2 мг/л викликає масову загибель риб. ГДК розчиненого кисню для водних об'єктів рибогосподарського призначення становить у зимовий період 4 мг/л, у літній – 6 мг/л.
, CH4 тощо), що містяться у воді, а також з диханням водних організмів. Швидкість споживання кисню збільшується з підвищенням температури, кількості бактерій та інших водних організмів і речовин, що піддаються хімічному і біохімічному окиснюванню. Залежно від ступеня забрудненості поверхневих вод, вміст розчиненого кисню може коливатися від 0 до 14 мг/л. Добові коливання в основному залежать від співвідношення інтенсивності процесів його продуціювання й споживання, і можуть досягати 2–3 мг/л розчиненого кисню. Вміст кисню у воді впливає на життєдіяльність фауни й флори водойм. Наприклад, мінімальний вміст розчиненого кисню, що забезпечує нормальний розвиток риб, становить близько 5 мг/л. Зниження його до 2 мг/л викликає масову загибель риб. ГДК розчиненого кисню для водних об'єктів рибогосподарського призначення становить у зимовий період 4 мг/л, у літній – 6 мг/л. .
. .
.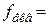 1); б)
1); б) 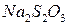 є нестійким при зберіганні тому, що реагує з вугільною кислотою, яка міститься у воді:
є нестійким при зберіганні тому, що реагує з вугільною кислотою, яка міститься у воді: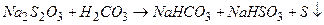 (16.1)
(16.1)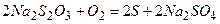 . (16.2)
. (16.2)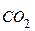 , і до 1 л води додають 0,1 г карбонату натрію для зв’язування
, і до 1 л води додають 0,1 г карбонату натрію для зв’язування 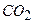 :
: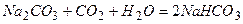 .
.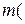
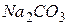 на 1 л розчину, після чого визначають концентрацію приготовленого розчину. Після стандартизації розчин зберігають у темній склянці, захищеній від проникнення
на 1 л розчину, після чого визначають концентрацію приготовленого розчину. Після стандартизації розчин зберігають у темній склянці, захищеній від проникнення 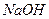 і
і 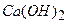 ).
).
 г/моль. Необхідну для приготування 1 л 0,02Н розчину
г/моль. Необхідну для приготування 1 л 0,02Н розчину 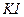 і
і 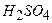 беруть з надлишком) додають точно відміряний об’єм розчину окисника
беруть з надлишком) додають точно відміряний об’єм розчину окисника 
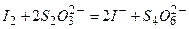 (16.3)
(16.3) ,
,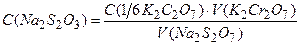 , моль/л.
, моль/л.
 . До отриманої суміші додають піпеткою 20 мл 0,02 н. розчину
. До отриманої суміші додають піпеткою 20 мл 0,02 н. розчину 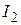 . Після цього годинникове скло знімають, ополіскують його над колбою, додають ще приблизно 200 мл дистильованої води і починають титрувати без індикатору від темно–брунатного до світло–жовтого забарвлення, після чого додають 5 мл 0,5% –вого розчину крохмалю (розчин забарвлюється в синій колір) і продовжують титрувати до появи від однієї краплини розчину
. Після цього годинникове скло знімають, ополіскують його над колбою, додають ще приблизно 200 мл дистильованої води і починають титрувати без індикатору від темно–брунатного до світло–жовтого забарвлення, після чого додають 5 мл 0,5% –вого розчину крохмалю (розчин забарвлюється в синій колір) і продовжують титрувати до появи від однієї краплини розчину 


