
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготування і стандартизація робочих розчинів
В якості робочих розчинів у методі нейтралізації використовують: розчини кислот (найчастіше 0,1 М або 0,05 М розчин (найчастіше 0,1 М або 0,05 М розчин 5.3.1. Приготування і стандартизація 0,1 М розчину HCl а) приготування 0,1 М розчину HCl з фіксаналу Фіксанали (стандарт–титри) — це запаяні в скляні ампули точно зважені маси твердих або точно відміряні об’єми рідких речовин, необхідні для приготування виключно 1 л розчину певної концентрації (наприклад, 0,1 М або 0,05 М тощо). Щоб приготувати 0,1 М. розчин б) приготування ~ 0,1 М розчину HCl з наявної кислоти У випадку відсутності фіксаналу, приймаючи до уваги леткість і токсичність хлоридної кислоти, її розчин готують наступним чином: 1) розраховують, яка кількість грамів НСl повинна міститися в 1 л 0,1М розчину: 2) оскільки чистої хлоридної кислоти не існує, то для подальших розрахунків визначають густину наявної хлоридної кислоти. Її виміряють ареометром, для чого останній занурюють у циліндр з кислотою, а потім за таблицею (див. Довідник хіміка) знаходять її відсоткову концентрацію за знайденою густиною кислоти; 3) розраховують, у якій кількості кислоти, що є в лабораторії, міститься потрібне число грамів чистої НСl; 4) оскільки зважувати кислоту незручно, то перераховують її масу на об’єм V, виходячи із співвідношення V= m/ r, (де m – маса кислоти, г; r – густина кислоти, г/см3); 5) відміряють знайдений об’єм кислоти циліндром або піпеткою, розводять дистильованою водою до 1 л у мірній колбі і ретельно перемішують отриманий розчин. Розчин переливають у чисту склянку, наносять маркування (концентрація, дата). в) стандартизація приготованого ~ 0,1 М розчину HCl
Стандартизацію розчину HCl проводять за первинним розчином бури (Na2B4O7 × 10H2O), який був приготовлений з фіксаналу. Концентрація цього розчину: С
Молярну концентрацію хлоридної кислоти встановлюється титруванням розчину бури з метиловим жовтогарячим 0,1М розчином хлоридної кислоти.
Хід визначення: 1.Приготований розчин х лоридної кислоти наливають через лійку в ретельно вимиту бюретку, яку перед тим ополіскують невеликими порціями розчину, для виведення залишків води, вище нульової позначки. Заповнюють розчином носик бюретки, витиснувши з нього повітряні бульбашки. Потім знімають лійку і встановлюють нижній край меніска розчину хлоридної кислоти на нульовій позначці. 2. Виконуючи всі правила, переносять піпеткою, яку двічі ополіскують розчином бури, в чисту конічну колбу 10 або 20 мл розчину бури, не видуваючи останню краплю з піпетки, а знімаючи її дотиком кінця піпетки до внутрішньої стінки колби для титрування, додають 2 – 3 краплини метилового жовтогарячого, після чого колбу підставляють під бюретку таким чином, щоб кінець бюретки ввійшов у колбу на 1 – 2 см, і починають титрування, поклавши заздалегідь під колбу білий аркуш паперу. Титрування проводять, підтримуючи колбу правою рукою, а лівою, відкриваючи кран бюретки, обережно невеликими порціями доливають хлоридну кислоту, при цьому вміст колби безперервно перемішують плавними обертальними рухами. Титрування вважають закінченим у той момент, коли забарвлення індикатора в розчині перейде (від додавання однієї краплі хлоридної кислоти) з жовтого в жовтогаряче (рН=4). Під час титрування зручно користуватися ”свідком”. Для цього в окрему колбу відміряють циліндром 50 мл дистильованої води, додають 1 – 2 краплини, метилового жовтогарячого, а з бюретки – 1 краплину розчину хлоридної кислоти. Розчин повинен мати помітне жовтогаряче забарвлення. При користуванні “свідком” титрування закінчують, коли розчин прийме колір “свідка”. Визначають за бюреткою (з точністю до сотих мілілітра) об’єм розчину кислоти, витраченої на титрування і занотовують дані в журнал.
Титрування повторюють кілька разів до отримання не менше, ніж трьох результатів, що відрізняються не більше, як на 0,1 мл, причому кожного разу рівень розчину в бюретці треба встановлювати на нуль, а при відліку стежити за тим, щоб око було на рівні меніску. Отримані результати занотовують у вигляді таблиці:
Знаходять середнє значення об’ємів хлоридної кислоти, витрачених на титрування, враховуючи тільки результати, що сходяться, і визначають її концентрацію із співвідношення: де
Отже остаточно
5.3.2. Приготування і стандартизація ~ 0,1 М робочого розчину лугу У методі нейтралізації в якості розчинів лугів використовують зазвичай 0,1 М розчин гідроксиду натрію. Оскільки NaOH е нергійно реагує з СО2 повітря, утворюючи на поверхні реактиву карбонати, та є гігроскопічним, то його розчин готують швидко, за приблизною наважкою. а) Приготування ~ 0,1 М розчину NaOH за наважкою Для приготування 1 л 0,1 М розчину гідроксиду натрію наважка NaOH повинна бути 4 г ( б) Приготування робочого ~0,1 М розчину NaOH методом розведення з 1 М розчину NaOH 1М розчин NaOH готують заздалегідь, виходячи з того, що для приготування, наприклад 1 л цього розчину потрібна наважка: Наважку беруть більшу (до 50 г), швидко зважуючи її на технічних вагах. Наважку вміщують у склянку, швидко ополіскують 2 – 3 рази малими порціями води. Промитий їдкий натр вміщують у калібровану на 1 л колбу і готують розчин. Спочатку слід долити невелику кількість води, а коли реактив розчиниться, дають розчинові охолонути і доводять об’єм розчину до позначки 1 л. Отриманий ~ 1М розчин є вихідним для подальшої роботи студентів. Кожен студент отримує індивідуальне завдання на приготування певного об’єму (V1) ~ 0,1 М розчину NaOH з 1 М розчину NaOH, виходячи з того, що в наявності є мірні колби місткістю 100, 110, 200, 220, 250 і 500 мл. Для приготування необхідного розчину слід розрахувати об’єм 1М розчину NaOH (V2), який потрібно взяти для приготування певного об'єму 0,1М розчину NaOH (V1). Наприклад, для приготування 100 мл 0,1 М розчину NaOH об’єм 1М розчину NaOH розраховують із співвідношення:
де
Отже об’єм 1М розчину NaOH, який потрібно взяти для приготування 100 мл 0,1М розчину розраховують як:
Для приготування 100 мл 0,1 М розчину NaOH піпеткою набирають10 мл 1М розчину NaOH і переносять його в чисту мірну колбу місткістю 100 мл, дистильованою водою доводять об’єм розчину до 100 мл, ретельно перемішують. в) Стандартизація приготованого ~ 0,1 М розчину NaOH Стандартизацію розчину NaOH виконують за відстандартизованим робочим розчином HCl або за 0,1 М розчином HCl, який приготували з фіксаналу. Для титрування сильної кислоти гідроксидом натрію можна вибрати будь-який індикатор, рН якого найближче підходить до рН = 7 (точка еквівалентності). У випадку титрування сильних кислот лугами (або навпаки) можна використовувати і метиловий жовтогарячий, і фенолфталеїн. Хід визначення. До колби на 200–250мл піпеткою вміщують 10–20 мл 0,1 М розчину HCl, додають 3–4 краплини метилового жовтогарячого і швидко титрують з бюретки розчином NaOH до переходу кольору від червоного через жовтогарячий до жовтого від однієї краплини NaOH (рН =4,4). З фенолфталеїном розчин HCl титрують від безкольорового до слабко рожевого забарвлення (рН=9), яке не зникає протягом 30 сек. Чи є різниця в результатах титрування і чому? Поясніть, чому при титруванні сильних кислот лугами (або навпаки) можна використовувати і метиловий жовтогарячий і фенолфталеїн? Титрування повторюють не менше ніж 3 рази; різниця у вимірюванні об’єму не повинна перевищувати 0,1 мл. Отримані результати занотовують до журналу у вигляді таблиці:
Розрахунок молярної концентрації лугу де
Лабораторна робота № 6
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 375; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.64.132 (0.014 с.) |
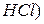 і розчини лугів
і розчини лугів .
.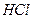 з фіксаналу, ампулу старанно вимивають і витирають. У мірну колбу на 1 л вставляють лійку з вкладеним у неї бойком таким чином, щоб довгий кінець його ввійшов у трубку лійки, а короткий (гострий) був направлений догори. Дно вимитої ампули пробивають гострим кінцем бійка в лійці. Другим бойком пробивають верхнє дно ампули і сильним струменем води повністю вимивають вміст ампули в колбу. Потім ретельно перемішують отриманий розчин і доводять його дистильованою водою до мітки 1 л. Отриманий розчин переливають у чисту склянку і наносять на неї маркування (концентрація, дата).
з фіксаналу, ампулу старанно вимивають і витирають. У мірну колбу на 1 л вставляють лійку з вкладеним у неї бойком таким чином, щоб довгий кінець його ввійшов у трубку лійки, а короткий (гострий) був направлений догори. Дно вимитої ампули пробивають гострим кінцем бійка в лійці. Другим бойком пробивають верхнє дно ампули і сильним струменем води повністю вимивають вміст ампули в колбу. Потім ретельно перемішують отриманий розчин і доводять його дистильованою водою до мітки 1 л. Отриманий розчин переливають у чисту склянку і наносять на неї маркування (концентрація, дата). = 0,1∙36,46∙1= 3,645 г;
= 0,1∙36,46∙1= 3,645 г; Na2B4O7 × 10H2O) = 0,1 моль/л. В основі стандартизації лежить наступна реакція:
Na2B4O7 × 10H2O) = 0,1 моль/л. В основі стандартизації лежить наступна реакція:
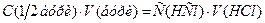 ,
,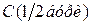 – молярна концентрація еквівалента бури, моль/л;
– молярна концентрація еквівалента бури, моль/л;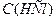 – молярна концентрація хлоридної кислоти, моль/л;
– молярна концентрація хлоридної кислоти, моль/л;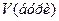 і
і 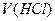 – об’єми відповідних розчинів, мл.
– об’єми відповідних розчинів, мл.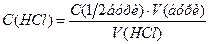 , моль/л.
, моль/л.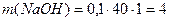 г), але замість розрахованих 4 г NaOH беруть 5–6 г. Наважку зважують швидко на технохімічних вагах у закритому бюксі. Після чого висипають її в склянку і ополіскують 2–3 раза малими порціями води. Промитий їдкий натр вміщують у калібровану на 1 л колбу, доливають невелику кількість води, а коли реактив повністю розчиниться, дають розчину охолонути і доводять об’єм розчину дистильованою водою до позначки. Ретельно перемішують і переливають у чисту склянку. Наносять маркування (концентрація, дата).
г), але замість розрахованих 4 г NaOH беруть 5–6 г. Наважку зважують швидко на технохімічних вагах у закритому бюксі. Після чого висипають її в склянку і ополіскують 2–3 раза малими порціями води. Промитий їдкий натр вміщують у калібровану на 1 л колбу, доливають невелику кількість води, а коли реактив повністю розчиниться, дають розчину охолонути і доводять об’єм розчину дистильованою водою до позначки. Ретельно перемішують і переливають у чисту склянку. Наносять маркування (концентрація, дата).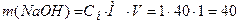 г.
г. ,
,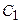 – молярна концентрація розчину, який потрібно приготувати;
– молярна концентрація розчину, який потрібно приготувати; – молярна концентрація розчину, з якого готують;
– молярна концентрація розчину, з якого готують;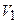 – об’єм розчину, який потрібно приготувати;
– об’єм розчину, який потрібно приготувати;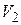 – об’єм розчину, з якого готують.
– об’єм розчину, з якого готують. мл
мл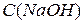 виконують за формулою:
виконують за формулою:  ,
,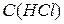 – молярна концентрація хлоридної кислоти в розчині, моль/л;
– молярна концентрація хлоридної кислоти в розчині, моль/л; 
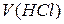 – об’єм розчину хлоридної кислоти, який взяли для титрування, мл;
– об’єм розчину хлоридної кислоти, який взяли для титрування, мл;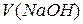 – об’єм розчину лугу, який пішов на титрування, мл.
– об’єм розчину лугу, який пішов на титрування, мл.


