
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення форм вуглекислотиСодержание книги
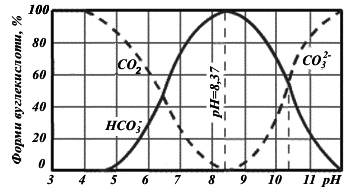
Поиск на нашем сайте Карбонатна кислота (вуглекислота) у воді може бути присутня в трьох формах: вільної (СО2), напівз’вязаної ( Діоксид вуглецю СО2, під час розчинення у воді, частково вступає з нею у взаємодію з утворенням карбонатної кислоти. Окремо визначити вміст діоксиду вуглецю і карбонатної кислоти у воді важко, тому сумарну концентрацію цих компонентів приймають за концентрацію вільної вуглекислоти. Так як тільки близько 1% розчиненого діоксиду вуглецю утворює карбонатну кислоту, розрахунок вмісту вільної вуглекислоти ведуть на діоксид вуглецю СО2. Концентрація вільної вуглекислоти кислоти в поверхневих водах може досягати 10—30 мг/л. Напівзв’язаною формою вуглекислоти у воді є гідрокарбонат - іони Гідрокарбонат-іони – найпоширеніша форма вуглекислоти в природних водах (до 300 мг/л). Вони зумовлюють лужність і карбонатну твердість води. При дисоціації вуглекислоти за 2-м ступенем утворюються карбонат-іони: Одночасно всі три форми вуглекислоти у воді існувати не можуть. Кожна з форм існує в певному інтервалі рН. З іншого боку, саме наявність тієї чи іншої форми вуглекислоти зумовлює те чи інше рН води. На рис. 7.1 наведена залежність відсоткового вмісту форм вуглекислоти від рН води.
Рис. 7.1. Залежність відсоткового вмісту форм вуглекислоти від рН води. З рис. 7.1 витікає, що: · якщо рН ≤ 4,4 у воді присутня тільки вільна вуглекислота. · в інтервалі рН від 4,4 до 8,37 у рівновазі знаходяться дві форми вуглекислоти – · в інтервалі рН від 8,37 до 12 у рівновазі знаходяться іони · при рН> 12 – тільки іони 7.3.1. Визначення вмісту вільної вуглекислоти Вільна вугільна кислота за рН більше 4,4 зумовлює загальну кислотність природних питних вод (рис. 7.1). Тому визначення вмісту вільної Розрахунок концентрації вільної вуглекислоти (ммоль/л ) виконують за формулою
Вміст вільної вуглекислоти (мг/л ) розраховують як
де Якщо рН води менше за 4,4, то концентрацію вільної вуглекислоти слід розраховувати як 7.3.2. Визначення вмісту гідрокарбонат-іонів В інтервалі рН від 4 до 9 гідрокарбонат-іони (
У кінці титрування реакція середовища, як можна бачити з рівняння, повинна бути слабко кислою, тому за індикатор беруть метиловий жовтогарячий. Методика визначення. В конічну колбу піпеткою відміряти 100 мл досліджуваної води, додати 3–4 краплини метилового жовтогарячого і титрувати 0,1 М розчином HCl від жовтогодо жовтогарячого забарвлення індикатора (рН = 4). Розрахунок концентрації іонів Вміст іонів де 7.3.3. Визначення карбонат-іонів а) визначення вмісту іонів При рН більше за 8,4 карбонат–іони внаслідок гідролізу зумовлюють вільну лужність води. Тому їх вміст визначають титруванням проби води 0,1 М розчином HCl у присутності фенолфталеїну від рожевого до слабко рожевого забарвлення, яке зникає від однієї краплини розчину HCl . При цьому має місце перебіг реакції:
Методика визначення. В конічну колбу місткістю 250 мл відміряти піпеткою 100 мл досліджуваної води, додати 3–4 краплини фенолфталеїну і титрувати 0,1 М розчином HCl до зникнення рожевого забарвлення ( Розрахунок концентрації іонів
де Вміст іонів
де – молярна маса іонів Розчин не виливають, а діють так, як описано нижче. б) визначення вмісту іонів Методика визначення вмісту іонів До відтитрованої з фенолфталеїном проби води (див. дослід 7.3.3.а) додати 3–4 краплини метилового жовтогарячого і титрувати 0,1 М розчином HCl до появи жовтогарячого забарвлення ( Розрахунок концентрації іонів
де
Вміст іонів 7.3.4. Розрахунок агресивної вуглекислоти Визначення агресивної вуглекислоти виконують, користуючись даними табл. 7.1. Введемо позначення: нехай S – це сума вільної і напівзв’язаної вуглекислоти ( Складемо знайдені кількості вільної і напівзв’язаної вуглекислоти (останню знаходять множенням ммоль/л Приклад. Вміст іону Віднімаючи вміст напівзв’язаної вуглекислоти від суми напівзв’язаної та агресивної вуглекислоти, знаходимо кількість агресивної вуглекислоти: СО2 = 118,1 – 100 = 18,1 (мг/л). Таблиця 7.1. Обчислення агресивної СО2
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 302; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

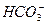 ) і зв’язаної (
) і зв’язаної ( ).
). , а також у результаті розчинення карбонатних порід під дією карбонатної кислоти:
, а також у результаті розчинення карбонатних порід під дією карбонатної кислоти: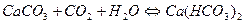

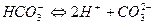 (зв’язана форма вуглекислоти). Вони містяться тільки в лужних водах (при рН>9) у присутності іонів
(зв’язана форма вуглекислоти). Вони містяться тільки в лужних водах (при рН>9) у присутності іонів 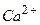 і
і 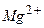 . Вміст
. Вміст 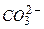 у природних водах невеликий внаслідок малої розчинності карбонату кальцію.
у природних водах невеликий внаслідок малої розчинності карбонату кальцію.
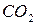 та іони
та іони 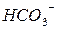 , причомуконцентрація останніхзростає з підвищенням рН і досягає максимального значенняпри рН 8,37.
, причомуконцентрація останніхзростає з підвищенням рН і досягає максимального значенняпри рН 8,37.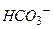 і
і  ;
;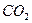 (4,4 < рН < 9)
(4,4 < рН < 9) . (7.1) Методика визначення. Піпеткою відміряти 100 мл досліджуваної води, додати 3–4 краплини фенолфталеїну і титрувати 0,1 М розчином NaOH (розчин лугу додавати краплинами). При цьому кожен раз закривати колбу гумовим корком і перемішувати вміст колби плавним похитуванням до появи слабкого рожевого забарвлення розчину, яке не повинно зникати протягом 2–3 хв.
. (7.1) Методика визначення. Піпеткою відміряти 100 мл досліджуваної води, додати 3–4 краплини фенолфталеїну і титрувати 0,1 М розчином NaOH (розчин лугу додавати краплинами). При цьому кожен раз закривати колбу гумовим корком і перемішувати вміст колби плавним похитуванням до появи слабкого рожевого забарвлення розчину, яке не повинно зникати протягом 2–3 хв. .
.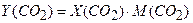 ,
, – молярна маса
– молярна маса  , ммоль/л.
, ммоль/л.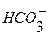 (напівзв’язаної вуглекислоти) – інтервал рН 4 < рН < 9
(напівзв’язаної вуглекислоти) – інтервал рН 4 < рН < 9

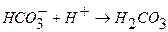 (7.2)
(7.2)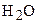
 (ммоль/л ) проводять за формулою
(ммоль/л ) проводять за формулою , (7.3)
, (7.3) , (7.4)
, (7.4) 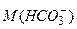 – молярна маса
– молярна маса  і гідрокарбонат-іонів
і гідрокарбонат-іонів 
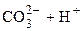
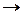
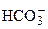 . (7.5)
. (7.5)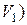 .
. 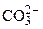 (ммоль/л) виконують за формулою
(ммоль/л) виконують за формулою ,
,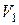 – об’єм 0,1 М розчину HCl, що пішов на титрування у присутності фенолфталеїну, мл;
– об’єм 0,1 М розчину HCl, що пішов на титрування у присутності фенолфталеїну, мл;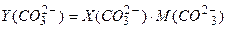
 ,
,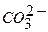 , що дорівнює 60 г/моль (фактор еквівалентності іонів
, що дорівнює 60 г/моль (фактор еквівалентності іонів 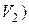 . При цьому гідрокарбонат–іони (і наявні раніше, і ті, що утворилися при титруванні
. При цьому гідрокарбонат–іони (і наявні раніше, і ті, що утворилися при титруванні 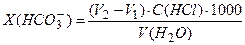 ,
, – об’єм HCl, що пішов на титрування з метиловим жовтогарячим, мл;
– об’єм HCl, що пішов на титрування з метиловим жовтогарячим, мл;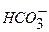 (мг/л) розраховують за формулою (7.4).
(мг/л) розраховують за формулою (7.4). +C
+C 


