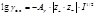Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Мембранное равновесие. Осмос. Осмотическое давление идеального раствора.
1.Мембранное равновесие. Осмос. *Равновесное состояние в растворах осуществляется при обязательном равенстве температуры и давления во всех частях всех сосуществующих фаз в системе, а также постоянства состава в каждой фазе. *Необходимым условием для достижения равновесия является возможность свободного перехода всех компонентов системы из одной фазы в другую. *Если же отдельные части системы разделены перегородками, которые непроницаемы для некоторых компонентов, то сосуществующие фазы могут находиться при разных давлениях, а равенство химических потенциалов установится только для тех компонентов, которые могут беспрепятственно переходить через перегородку (мембрану). Самопроизвольный переход растворителя через полупроницаемую перегородку в раствор называется осмосом, а сила (на единицу площади), заставляющая растворитель переходить через эту перегородку в раствор, находящийся при том же внешнем давлении, что и растворитель, называется 2. осмотическим давлением Осмотическое давление (p) равно тому избыточному внешнему давлению, которое нужно приложить к раствору, чтобы предотвратить осмос. Осмотическое давление идеального раствора
Уравнение Вант-Гоффа показывает, что осмотическое давление равно давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало бы тот же объем, что и в растворе при той же температуре 2. Теория Дебая-Хюккеля. Ионная сила. Теория ассоциации растворов. Теория Дебая-Хюккеля (1923) *Вокруг каждого иона в растворе имеется атмосфера из заряженных ионов, причем вследствие электростатического взаимодействия вокруг каждого положительного иона имеется избыток отрицательных, а вокруг каждого отрицательного – избыток положительных. *Плотность ионной атмосферы, максимальная у центрального иона, с удалением от него уменьшается. *На некотором расстоянии (границе) ионной атмосферы, число ионов каждого знака становится одинаковым. *Термодинамические свойства растворов связаны с параметрами ионной атмосферы – ее размером и плотностью. Основное уравнение
Уравнение зависимости γ±=f(I1/2) называют предельным законом Дебая, а коэффициент А –предельным коэффициентом или коэффициентом предельного закона Дебая.
Теория ассоциации растворов Энергия электростатического взаимодействия U
Бьеррум: Условие образования ассоциата: z1∙z2∙e2/(ε∙r) > 2kT (где 2kT – согласно теории ассоциации является критической энергией образования ассоциата, кинетическая энергия 2-х противоположно заряженных ионов). Пример: если противоположно 1,1-заряженные ионы находятся на расстоянии г < 3.57Å, то в водном растворе они образуют ассоциат или ионную пару. 3.Отклонение реальных растворов от идеальных зависит не только от концентрации ионов, но и от величины их заряда. Оба эти фактора учитывает величина, называемая ионной силой раствора (m, I) равная полусумме произведения молярной концентрации всех ионов в растворе на квадрат заряда каждого иона:
|
|||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 100; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.29.224 (0.005 с.) |
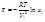

 В разбавленных растворах n 2 << n 1
В разбавленных растворах n 2 << n 1