
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Второй закон (начало) термодинамики. Энтропия. Стандартный тепловой эффект. Стандартное состояние.Стр 1 из 10Следующая ⇒
Второй закон (начало) термодинамики. Энтропия. Стандартный тепловой эффект. Стандартное состояние. 1.Второй закон термодинамики – постулат, который утверждает наличие в природе ассиметрии, выражающейся в односторонности и необратимости происходящих в ней неравновесных процессов. С. Карно (1824): в тепловых машинах теплота, полученная от теплоисточника, не может быть полностью переведена в механическую работу; часть ее должна быть передана третьему телу – холодильнику Второй закон (начало) термодинамики. Современная формулировка Принцип существования энтропии: для каждой термодинамической системы существует физическая величина (энтропия), значение которой зависит от состояния системы и изменение которой происходит под действием энергии, передаваемой в виде теплоты Энтропия Цикл Карно: КПД не зависит от природы рабочего тела, а
Значение т.е. существует некоторая функция состояния и изменение которой может быть вычислено как: Объединяя оба закона термодинамики, получим фундаментальное уравнение термодинамики (Гиббса):
Фазовые превращения.(продолжение 7) Фазовые (агрегатные) превращения (плавление, испарение) происходят при пост Т и P.
при p, Т = const: где ΔStr – изменение энтропии при фазовых превращениях; Ttr – температура фазового перехода Стандартный тепловой эффект. Стандартное состояние Под стандартным тепловым эффектом понимают его величину при давлении 1,01325 ∙105 Па (760 мм рт.ст., За стандартное состояние чистого жидкого или твердого (кристаллического) вещества принимается его наиболее устойчивое физическое состояние при данной температуре и стандартном давлении. В качестве стандартного состояния для газа принято гипотетическое (воображаемое) состояние, при котором газ, находясь при стандартном давлении, подчиняется законам идеальных газов, а его энтальпия равна энтальпии реального газа.
Закон Рауля(продолжение 2) При постоянной температуре давление пара растворителя над раствором было пропорционально его мольной доли в растворе
Для бинарных растворов:
Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества Если бинарный (идеальный) раствор состоит из двух летучих компонентов, а пар обладает свойствами идеального газа, то закон Рауля справедлив как для растворителя, так и для растворенного вещества:
Общее давление пара над идеальным раствором равно сумме парциальных давлений пара отдельных компонентов
Подвижность ионов Электрическая проводимость определяется числом ионов, которые проходят через поперечное сечение проводника в единицу времени (скоростью движения ионов, ui’). Общая сила тока I, проходящего через раствор, обусловлена тем количеством электричества, которое переносится в единицу времени катионами и анионами: Закон Кольрауша Предельная молярная или предельная эквивалентная электрические проводимости будут равны:
Последнее уравнение является выражением закона Кольрауша: эквивалентная электрическая проводимость при бесконечном разведении равна сумме предельных подвижностей ионов. Предельная электрическая проводимость или предельные подвижности ионов являются важными константами, характеризующими способность данного электролита проводить электрический ток в растворе. Теплоемкость Общая теплоемкость системы – это количество теплоты, которое необходимо для повышения температуры системы на один градус. Поскольку она является экстенсивной величиной, то более удобно пользоваться теплоемкостью, отнесенной к единице количества вещества. В зависимости от этого различают удельную (на 1 г или 1 кг массы) и мольную (на 1 моль) теплоемкости. В зависимости от условий нагревания различают – теплоемкость при постоянном объеме, СV (при V = const) и теплоемкость при постоянном давлении, Теплоемкости зависят от природы вещества, а также от температуры.
Истинная теплоемкость – теплоемкость при заданной температуре
Формула Майера Для идеальных газов (формула Майера): Для реальных газов: Для твердого тела при обычной температуре разность cp - cV < R и составляет около 1 Дж/(моль∙К). Величина Для твердых тел справедливо эмпирическое уравнение: где Tm – температура плавления Расчет теплоемкости Для идеальных газов теплоемкость определяется только поступательным движением их молекул. Из молекулярно-кинетической теории вытекает, что мольная теплоемкость одноатомного газа равна В действительности наблюдаются значительные отклонения от теоретических значений. Расчеты по формулам этих теорий дают правильные результаты лишь для некоторых веществ в ограниченном температурном интервале. Поэтому для расчетов теплоемкостей и тепловых эффектов при разных температурах используют экспериментальные величины теплоемкостей: c р = a +b∙T +c∙T 2 c р = a +b∙T +c*∙T -2+d∙T 2 В справочных таблицах приводятся значения коэффициентов (a, b, c, c*, d) и интервал температур, Уравнение изотермы
Уравнение изотермы:
Уравнение изобары (изохоры)
Теория Дебая-Хюккеля (1923) *Вокруг каждого иона в растворе имеется атмосфера из заряженных ионов, причем вследствие электростатического взаимодействия вокруг каждого положительного иона имеется избыток отрицательных, а вокруг каждого отрицательного – избыток положительных. *Плотность ионной атмосферы, максимальная у центрального иона, с удалением от него уменьшается. *На некотором расстоянии (границе) ионной атмосферы, число ионов каждого знака становится одинаковым. *Термодинамические свойства растворов связаны с параметрами ионной атмосферы – ее размером и плотностью. Основное уравнение
Уравнение зависимости γ±=f(I1/2) называют предельным законом Дебая, а коэффициент А –предельным коэффициентом или коэффициентом предельного закона Дебая. Теория ассоциации растворов Энергия электростатического взаимодействия U
Бьеррум: Условие образования ассоциата: z1∙z2∙e2/(ε∙r) > 2kT (где 2kT – согласно теории ассоциации является критической энергией образования ассоциата, кинетическая энергия 2-х противоположно заряженных ионов).
Пример: если противоположно 1,1-заряженные ионы находятся на расстоянии г < 3.57Å, то в водном растворе они образуют ассоциат или ионную пару. 3.Отклонение реальных растворов от идеальных зависит не только от концентрации ионов, но и от величины их заряда. Оба эти фактора учитывает величина, называемая ионной силой раствора (m, I) равная полусумме произведения молярной концентрации всех ионов в растворе на квадрат заряда каждого иона:
Модель Борна Согласно модели М. Борна ион рассматривается как заряженный шарик радиусом ri, а растворитель как сплошная однородная среда с диэлектрической проницаемостью ε. Процесс переноса шарика из вакуума в среду разбивается на 3 этапа: 1.Разряд шарика в вакууме 2.Перенос незаряженного шарика из вакуума в растворитель 3.Заряжение шарика в
(Продолжение 3) *При этом предполагается, что работа на втором этапе равна нулю, а для расчета работы на этапах 1 и 3 используется закон Кулона
где φ – потенциал на Напряженность поля связана с электрическим потенциалом как: Теория Борна является приближенной, и рассчитанные энергии сольватации лишь качественно правильно отражают зависимости от заряда и радиуса ионов. Для получения корректных данных нужно учесть структуру растворителя, а также различные силы взаимодействия, кроме электростатических Типы электродов Электроды первого рода *Катионные электроды (потенциал зависит от активности катионов) – устанавливается равновесие между электронейтральными частицами (например, атомами металла) и соответствующими катионами в растворе. Различают металлические (цинковый, медный, серебряный и т.д.), амальгамные (амальгамы щелочных и щелочноземельных металлов) электроды, газовый водородный электрод. *Анионные электроды (потенциал зависит от активности анионов) – устанавливается равновесие между электронейтральными частицами и анионами – хлорный, бромный, иодный. Если анионный электрод является газовым, то в уравнение для электродного потенциала включается также давление газа. Например, потенциал хлорного электрода Рt,Cl2|Cl– равен: Электроды второго рода Состоят из трех фаз – металла, его труднорастворимой соли и раствора, содержащего анионы этой соли. На этих электродах устанавливается равновесие между атомами металла и анионами в растворе как результат двух частных равновесий: между металлом и катионом труднорастворимой соли и между анионом в твердой фазе этой соли и анионом в растворе (Аz–|MA|M).
Окислительно-восстановительные электроды. Состоят из индифферентного проводника (обычно платина или углерод, иногда золото, палладий), погруженного в раствор, который содержит окисленную и восстановленную формы одного и того же вещества (Fe3+–Fe2+, Sn4+–Sn2+, MnO2–Mn2+, H3AsO4–H3AsO3 и т.п.) Металл электрода служит лишь посредником в обмене электронами между двумя формами. Мембранные (ион-селективные) электроды. Обе граничащие фазы – мембрана и раствор – имеют ионную проводимость и поэтому на их границе не протекает собственно электрохимическая реакция с переносом электронов. Процесс сводится в этом случае к обмену ионами При соответствующем подборе состава и структуры мембраны потенциал на межфазной границе будет зависеть только от какого-либо одного вида ионов. Это дает возможность измерять активность отдельного вида ионов (селективность по какому-то иону).
| 3.Влияние различных факторов на равновесие химической реакции.
1. Потенциалы взаимодействия для термодинамической системы можно считать равными соответствующим величинам для окружающей среды. Равновесный процесс протекает при бесконечно малой разности потенциалов взаимодействия.
2. Система в любой момент процесса может считаться находящейся в равновесном состоянии.
3. Количество энергии, отданное окружающей средой системе в определенной форме, всегда равно количеству энергии, воспринятому системой в той же форме обмена энергией
4. Равновесный процесс протекает бесконечно медленно
При химическом равновесии скорость реакции в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрация исходных веществ и продуктов реакции не изменяется во времени и называются равновесными концентрациями. Для характеристики состава химического равновесия было введено понятие константа химического равновесия. Эта величина определяется из закона действующих масс и представляет собой отношение концентраций продуктов реакций и исходных веществ.
Влияние различных факторов на сдвиг химического равновесия:
1)Влияние температуры.
С повышением температуры равновесие смещается в сторону эндотермических реакций, т.е. реакций протекание которых обеспечивает поглощение теплоты. Повышение температуры вызывает увеличение константы равновесия, соответственно возрастают отношения концентраций продуктов реакции к концентрации исходных веществ, т.е. равновесие смещается в сторону эндотермической реакции.
2)Влияние общего давления в системе
Если в результате реакции изменяется число молей газообразного вещества, то изменение общего давления в системе вызывает смещение равновесия в соответствии с принципом Ле-Шателье, увеличение общего давления в системе вызывает смещение равновесия в сторону уменьшения числа молей газообразного вещества, т.е. в сторону уменьшения давления.
3)Влияние концентрации компонентов системы.
Если в систему добавить Метан, т.е. увеличить концентрацию, то равновесие системы нарушится. При этом ускоряется прямая реакция, что приводит к увеличению концентрации продуктов реакции. В результате происходит уменьшение концентрации газообразной воды и равновесие смещается вправо. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новое равновесие концентрации всех компонентов будет таким, чтобы константа равновесия оставалась постоянной.
Δ H >0 (эндотермическая реакция, поглощение тепла): увеличение температуры (уменьшение 1/T) приводит к увеличению константы равновесия, равновесие смещается в сторону продуктов реакции
ΔH<0 (экзотермическая реакция, выделение тепла): увеличение температуры (уменьшение 1/T) приводит к уменьшению константы равновесия, равновесие смещается в сторону исходных веществ
Принцип Ле-Шателье-Брауна: если на систему, находящуюся в состоянии равновесия оказать какое-либо воздействие, то равновесие в системе сместится в том направлении, что оказанное воздействие уменьшится
6. Термохимия. Закон Гесса и следствия из него. Теплота образования и тепловой эффект химической реакции. Зависимость теплового эффекта химической реакции от температуры
1.Термохимия – раздел химической термодинамики, посвященный исследованиям тепловых эффектов химических реакций, теплот фазовых переходов, теплот растворения веществ и т.д.
Под тепловым эффектом химической реакции понимают количество теплоты, которое выделяется или поглощается при условиях: а) процесс протекает необратимо при постоянном объеме или давлении; б) в системе не совершается никаких работ, кроме работы расширения системы; в) продукты реакции имеют ту же температуру, что и исходные вещества.
Экзотермические реакции – выделение тепла
Эндотермические реакции – поглощение тепла
2.Закон Гесса
Тепловой эффект химической реакции не зависит от пути протекания процесса (промежуточных стадий), а определяется лишь начальным и конечным состояниями системы (т.е. состоянием исходных веществ и продуктов реакции)
Закон Гесса выполняется при условии протекания реакции при постоянном давлении или при постоянном объеме (что реально соблюдается в подавляющем большинстве случаев)
Связь изобарного и изохорного тепловых эффектов:
Qp – QV = ΔUp + р∙ΔV – ΔUV.≈ р∙ΔV
Разностью изобарного и изохорного тепловых эффектов можно пренебречь, если в реакции участвуют вещества только в твердом и жидком состоянии.
Следствия из закона Гесса
1. Тепловой эффект разложения химического соединения до определенных продуктов равен по величине и противоположен по знаку тепловому эффекту образования этого соединения из тех же продуктов
2. Разность между тепловыми эффектами превращения двух различных химических систем в одинаковые продукты реакции равна тепловому эффекту перехода одной системы в другую.
3. Разность между тепловыми эффектами превращения двух одинаковых химических систем в различные продукты реакции равна тепловому эффекту, соответствующему превращению одних продуктов реакции в другие
ВЫВОД: Термохимические уравнения можно складывать и вычитать подобно алгебраическим
3.Теплота образования
Под теплотой образования (энтальпией образования) понимают то количество теплоты, которое выделяется или поглощается при образовании одного моля вещества (атома, молекулы) из простых веществ, взятых в термодинамически устойчивом состоянии при рассматриваемых условиях – обычно 298 К и 1 атм.
Энтальпию (теплоту) образования простых веществ при стандартном давлении и 298 К и в термодинамически устойчивом состоянии (Н2, Сl2, Sромб, Сграфит) принимают равной нулю.
 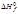 Энтальпии образования при стандартных условиях и 298 К табулированы в справочниках, их принято обозначать или
Теплота образования и тепловой эффект химической реакции Энтальпии образования при стандартных условиях и 298 К табулированы в справочниках, их принято обозначать или
Теплота образования и тепловой эффект химической реакции
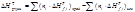 Энтальпия (тепловой эффект) химической реакции равняется разности между суммами энтальпий (теплот) образования продуктов реакции и энтальпий (теплот) образования исходных веществ в соответствии с их стехиометрическими коэффициентами: Энтальпия (тепловой эффект) химической реакции равняется разности между суммами энтальпий (теплот) образования продуктов реакции и энтальпий (теплот) образования исходных веществ в соответствии с их стехиометрическими коэффициентами:
 Для стандартного давления и 298 К справедливо:
4.Зависимость теплового эффекта химической реакции от температуры
Для реакции:
n1A + n2B = n3C + n4D Для стандартного давления и 298 К справедливо:
4.Зависимость теплового эффекта химической реакции от температуры
Для реакции:
n1A + n2B = n3C + n4D
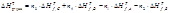 Если реакция протекает при постоянном давлении, то изменение энтальпии равно теплоте Qp.
Если реакция протекает при постоянном давлении, то изменение энтальпии равно теплоте Qp.
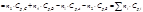  Дифференцируя, получим:
9. Принципы статистической термодинамики. Статистический смысл энтропии. Сумма по состояниям, ее связь с энтропией и внутренней энергией.
Принципы статистической т/д.
Статистический смысл энтропии.
При описании систем можно использовать 2 подхода: микро- и макросскопический. подробно хар-ся микросостояние системы. Для макросостояний исп-ует небольшое число переменных (Т,V, n). Каждому макросостоянию соотв-ет несколько микросостояний.
Т/д вероятность – это число микросостояний, с помощью которых можно осуществить данное макросостояние. Дифференцируя, получим:
9. Принципы статистической термодинамики. Статистический смысл энтропии. Сумма по состояниям, ее связь с энтропией и внутренней энергией.
Принципы статистической т/д.
Статистический смысл энтропии.
При описании систем можно использовать 2 подхода: микро- и макросскопический. подробно хар-ся микросостояние системы. Для макросостояний исп-ует небольшое число переменных (Т,V, n). Каждому макросостоянию соотв-ет несколько микросостояний.
Т/д вероятность – это число микросостояний, с помощью которых можно осуществить данное макросостояние.
 По закону распределения Больцмана число молекул N i, обладающих энергией ε i :
где А – константа.
Общее число молекул равно: По закону распределения Больцмана число молекул N i, обладающих энергией ε i :
где А – константа.
Общее число молекул равно:
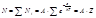 где Z – статистическая сумма по состояниям.
где Z – статистическая сумма по состояниям.
 Сумма по состояниям мультипликативна, т.е. общая сумма по состояниям является произведение сумм по состояниям, соответствующих отдельным независимым видам движения:
Энтропия системы связана с т/д вероятностью: S= f(W).
По принципу Больцмана: Энтропия системы в данном состоянии пропорц т/д веятности этого состояния.
S =k∙lnW где k – постоянная Больцмана (k = R / NA =1.38∙10-23 Дж/К)
1 2. Химический потенциал. Химический потенциал идеальных газов.
1. Химический потенциал. Физический смысл: Химический потенциал компонента характеризует изменение экстенсивной характеристической функции при добавлении 1 моль этого компонента к бесконечно большому количеству этого компонента при постоянных условиях Сумма по состояниям мультипликативна, т.е. общая сумма по состояниям является произведение сумм по состояниям, соответствующих отдельным независимым видам движения:
Энтропия системы связана с т/д вероятностью: S= f(W).
По принципу Больцмана: Энтропия системы в данном состоянии пропорц т/д веятности этого состояния.
S =k∙lnW где k – постоянная Больцмана (k = R / NA =1.38∙10-23 Дж/К)
1 2. Химический потенциал. Химический потенциал идеальных газов.
1. Химический потенциал. Физический смысл: Химический потенциал компонента характеризует изменение экстенсивной характеристической функции при добавлении 1 моль этого компонента к бесконечно большому количеству этого компонента при постоянных условиях
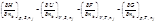 Дж. Гиббс (1876) предложил называть общуюю производную химическим потенциалом компонента μ k:
Дж. Гиббс (1876) предложил называть общуюю производную химическим потенциалом компонента μ k:
 Записанные с учетом химического потенциалы основные уравнения термодинамики имеют вид:
Записанные с учетом химического потенциалы основные уравнения термодинамики имеют вид:
Для большинства термодинамических расчетов используют энергию Гиббса, так как она определена через наиболее удобные независимые параметры (давление, температура, состав) и при p, T = const может быть выражена как dGT , p = ∑ μ i dni Растворы
Активность связана с концентрацией (мольной долей, молярной концентрацией) через коэффициент активности:
…………………………………………………………………………………….. (продолжение 14) ΔH>0 (эндотермическая реакция, поглощение тепла): увеличение температуры (уменьшение 1/T) приводит к увеличению константы равновесия, равновесие смещается в сторону продуктов реакции ΔH<0 (экзотермическая реакция, выделение тепла): увеличение температуры (уменьшение 1/T) приводит к уменьшению константы равновесия, равновесие смещается в сторону исходных веществ Принцип Ле-Шателье-Брауна: если на систему, находящуюся в состоянии равновесия оказать какое-либо воздействие, то равновесие в системе сместится в том направлении, что оказанное воздействие уменьшится
Величина Kр0 (K0), выраженная через парциальные равновесные давления компонентов, зависит только от температуры и не зависит от суммарного давления и парциальных давлений компонентов в исходной смеси; при постоянной температуре K0 = const 1. Δν <0 (ν 3 + ν 4 - ν 1 - ν 2 <0). K 0 увеличивается с ростом p 0. Равновесие смещается в сторону продуктов реакции 2. Δν >0 (ν 3 + ν 4 - ν 1 - ν 2 >0). K 0 уменьшается с ростом p 0. Равновесие смещается в сторону исходных веществ 3. Δν =0. На состав равновесной смеси изменение давления не влияет Неидеальные растворы *Реальные растворы, в основном, не подчиняются законам идеальных растворов *Если давление пара над реальным раствором больше, чем над идеальным раствором такого же состава, отклонения от закона Рауля называются положительными, а если меньше — отрицательными. *У растворов, образованных летучими компонентами, отклонения называют положительными, если общее давление пара больше аддитивной величины, и отрицательными — если оно меньше. *Знак и величина отклонения зависят от природы растворителя и растворенного вещества. *В сложных растворах знак отклонения от закона Рауля может изменяться с составом раствора. Второй закон (начало) термодинамики. Энтропия. Стандартный тепловой эффект. Стандартное состояние. 1.Второй закон термодинамики – постулат, который утверждает наличие в природе ассиметрии, выражающейся в односторонности и необратимости происходящих в ней неравновесных процессов. С. Карно (1824): в тепловых машинах теплота, полученная от теплоисточника, не может быть полностью переведена в механическую работу; часть ее должна быть передана третьему телу – холодильнику Второй закон (начало) термодинамики. Современная формулировка Принцип существования энтропии: для каждой термодинамической системы существует физическая величина (энтропия), значение которой зависит от состояния системы и изменение которой происходит под действием энергии, передаваемой в виде теплоты Энтропия Цикл Карно: КПД не зависит от природы рабочего тела, а
Значение т.е. существует некоторая функция состояния и изменение которой может быть вычислено как: Объединяя оба закона термодинамики, получим фундаментальное уравнение термодинамики (Гиббса):
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 103; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.10.116 (0.089 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||

 не зависит от пути процесса,
не зависит от пути процесса,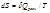
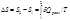

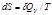
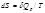

 Расчет энтропии
Расчет энтропии
 Теплота такого перехода = изм-ию энтальпии при фазовом превращении ΔHtr, поэтому
Теплота такого перехода = изм-ию энтальпии при фазовом превращении ΔHtr, поэтому


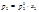

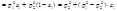
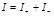
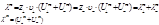

 Средняя теплоемкость – теплоемкость в заданном температурном интервале (от Т1 до Т2):
Средняя теплоемкость – теплоемкость в заданном температурном интервале (от Т1 до Т2):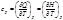
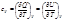
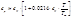
 В случае, если p,T=const и ξ=1, а относительные парциальные давления в реакционной смеси равны pi’ (неравновесная система) справедливо:
В случае, если p,T=const и ξ=1, а относительные парциальные давления в реакционной смеси равны pi’ (неравновесная система) справедливо:
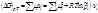
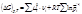


 Изобары Изохоры
Изобары Изохоры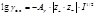


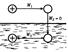 Электрическая работа заряжения сферы равна:
Электрическая работа заряжения сферы равна: 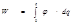
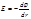
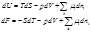
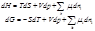
 Г. Льюис (1901): вместо мольнодолевой концентрации в уравнение потенциала подставляют новую переменную - активность (аi):
Г. Льюис (1901): вместо мольнодолевой концентрации в уравнение потенциала подставляют новую переменную - активность (аi):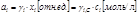
 4.Закон действующих масс
4.Закон действующих масс


