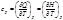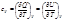Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коэффициент электропроводности
Отношение сумм подвижностей катинов и анионов при некоторой определенной концентрации и бесконечном разведении называется коэффициентом электропроводности:
(продолжение 5) Электрические подвижности ионов в разбавленных растворах слабых электролитов и в бесконечно разбавленных (f λ = 1), Для сильных электролитов, степень диссоциации электролита стремится к 1,
4.Числа переноса и методы их определения. *Каждый вид ионов переносит определенное количество электричества, зависящее от заряда и концентрации ионов и скорости их движения в электрическом поле. *Для оценки доли участия данного вида ионов в переносе электричества введено понятие о числе переноса.
Числа переноса, как и подвижности, меняются с температурой, однако в меньшей степени, так как числа переноса зависят от отношения подвижностей. Так как подвижности ионов зависят от концентрации, то от нее зависят и числа переноса.
Предельные числа переноса характеризуют долю тока, переносимого катионами и анионами при отсутствии ион-ионного взаимодействия Методы определения чисел переноса
Величины ΔnA и ΔnK определяют анализом растворов в анодном и катодном отделениях после окончания процесса электролиза, а Δn находят по закону Фарадея *Метод движущейся границы Метод основан на наблюдении границы aб между двумя растворами электролитов – исследуемым и вспомогательным (индикаторным).
*Метод Крауса-Брея: преобразуя уравнение:
Получая экспериментально зависимость в координатах 1/λ – λ∙c, определяем тангенс угла наклона прямой, который равен 1/((λ∞)2∙Kдисс). Отрезок, отсекаемый прямой на оси ординат, равен 1/λ∞.
Термодинамика: 1. Классификация термодинамических систем. 2. Равновесные и неравновесные процессы. 3. Влияние различных факторов на равновесие химической реакции.
4. Связь форм обмена энергии с координатами состояния и потенциалами взаимодействия. Функции состояния. Уравнения состояния. 5. Первое начало термодинамики. Применение I начала термодинамики для изобарных, изохорных и изотермических процессов. Понятие энтальпии. Теплоемкость, связь между средней и истинной теплоемкостью. Связь между Сp и Сv, формула Майера. 6. Термохимия. Закон Гесса и следствия из него. Теплота образования и тепловой эффект химической реакции. Зависимость теплового эффекта химической реакции от температуры 7. Второй закон (начало) термодинамики. Энтропия. Стандартный тепловой эффект. Стандартное состояние. 8. Характеристические функции: внутренняя энергия, энтропия, энергия Гиббса, энергия Гельмгольца. 9. Принципы статистической термодинамики. Статистический смысл энтропии. Сумма по состояниям, ее связь с энтропией и внутренней энергией. 10. Связь между энтальпией, энтропией и энергией Гиббса. Зависимость энергии Гиббса от температуры. Уравнения Гиббса-Гельмгольца. Интегрирование уравнений Гиббса-Гельмгольца. 11. Третье начало термодинамики. 12. Химический потенциал. Химический потенциал идеальных газов. 13. Парциальные молярные свойства. Уравнение Гиббса-Дюгема 14. Химическое равновесие. Уравнение изобары. Уравнение изотермы. Закон действующих масс. Химическое равновесие в гетерогенных системах. 15. Химическое равновесие в реальных системах. Газы. Растворы. Растворы: 1. Парциальные молярные свойства, методы их определения. 2. Термодинамические свойства идеальных растворов. Закон Рауля. Температура кипения идеального раствора. Температура замерзания идеального раствора. 3. Мембранное равновесие. Осмос. Осмотическое давление идеального раствора. 4. Неидеальные растворы. Причины отклонения от идеальности. Предельно разбавленные растворы. Закон Генри. Функции смешения реальных растворов. Методы определения активностей. Электрохимия: 1. Электролитическая диссоциация в растворе. Степень диссоциации. Константа диссоциации и способы ее определения. Специфика растворов электролитов. Электролитическая диссоциация в растворе. Теория Аррениуса.
2. Теория Дебая-Хюккеля. Ионная сила. Теория ассоциации растворов. 3. Термодинамические свойства ионов в растворе. Термодинамика ионной сольватации. Модель Борна. 4. Неравновесные явления в электролитах, основные понятия. Законы Фарадея. Молярная электрическая проводимость сильных и слабых электролитов. Удельная электрическая проводимость сильных и слабых электролитов. Зависимости æ и λ от концентрации и температуры. 5. Подвижность ионов. Закон Кольрауша. Коэффициент электропроводности. Числа переноса и методы их определения. 6. Механизм возникновения электродного потенциала. Равновесный потенциал. Контактная разность потенциалов. Диффузионный потенциал. 7. Термодинамика электрохимических элементов. Определение электродных потенциалов, уравнение Нернста. Типы электродов. Типы электрохимических цепей.
| 2.Равновесные и неравновесные процессы
Равновесным называется процесс, протекающий бесконечно медленно и представляющий собой непрерывную последовательность равновесных состояний. Система, совершившая равновесный процесс, может вернуться в исходное положение, пройдя в обратном направлении те же равновесные состояния, что и в прямом процессе (обратимость).
В результате неравновесного процесса невозможно возвратить и систему, и ее окружение к первоначальному состоянию. Практически все реальные процессы являются неравновесными, так как они идут с конечной скоростью и сопровождаются неустранимыми потерями (трение, теплопередача и т.д.), и не могут быть точно описаны термодинамикой.
5.Первое начало термодинамики. Применение I начала термодинамики для изобарных, изохорных и изотермических процессов. Понятие энтальпии. Теплоемкость, связь между средней и истинной теплоемкостью. Связь между Сp и Сv, формула Майера
1.Первый закон термодинамики – это закон сохранения энергии
Изменение внутренней энергии термодинамической системы равно разнице между количеством теплоты, подведенной к системе, и количеством механической и немеханических работ, совершенной системой
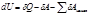 Первый закон термодинамики представляет собой постулат, т.е. базируется на многочисленных опытах. Его верность проверяется путем сопоставления вытекающих из него следствий с опытом. Пока в истории науки не найдено опытных данных, противоречащих этому закону.
Математическая запись
где dU - элементарное изменение внутренней энергии; U – функция состояния системы, это полный дифференциал, т.е. изменение ее не зависит от пути процесса; δA и δQ – бесконечно малые количества элементарных работ и элементарного количества теплоты; это функции процесса, их значения зависят от пути процесса.
Альтернативная формулировка
Внутренняя энергия любой изолированной системы остается постоянной, несмотря на протекающие в ней процессы
Принцип существования внутренней энергии
Существует экстенсивная функция состояния – внутренняя энергия, мерой изменения которой служат количества воздействий (теплота и различного рода работы) Первый закон термодинамики представляет собой постулат, т.е. базируется на многочисленных опытах. Его верность проверяется путем сопоставления вытекающих из него следствий с опытом. Пока в истории науки не найдено опытных данных, противоречащих этому закону.
Математическая запись
где dU - элементарное изменение внутренней энергии; U – функция состояния системы, это полный дифференциал, т.е. изменение ее не зависит от пути процесса; δA и δQ – бесконечно малые количества элементарных работ и элементарного количества теплоты; это функции процесса, их значения зависят от пути процесса.
Альтернативная формулировка
Внутренняя энергия любой изолированной системы остается постоянной, несмотря на протекающие в ней процессы
Принцип существования внутренней энергии
Существует экстенсивная функция состояния – внутренняя энергия, мерой изменения которой служат количества воздействий (теплота и различного рода работы)
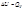 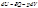 Изохорный процесс (dV=0) Изохорный процесс (dV=0)
При изохорном процессе вся теплота, подведенная к системе, расходуется на увеличение ее внутренней энергии. В случае V = const, теплота – функция состояния
Изотермический процесс(dT=0) для идеальных газов
где величина Н = (U + pV) называется энтальпией системы. Энтальпия, как и внутренняя энергия, является функцией состояния, и ее изменения не зависят от пути процесса. Tеплота Qp при изобарическом процессе также приобретает свойства функции состояния. 2.Энтальпия является функцией состояния, то есть ее изменение не зависит от пути протекания этого изменения, а определяется лишь значением энтальпии в начале процесса и в конце процесса Энтальпия имеет ту же размерность, что и внутренняя энергия, это тоже экстенсивное свойство, то есть она зависит от массы системы. В настоящее время на определении изменения энтальпии основан расчет тепловых балансов химических реакций: Тепловой эффект реакции = - ΔHреакции Теплоемкость Общая теплоемкость системы – это количество теплоты, которое необходимо для повышения температуры системы на один градус. Поскольку она является экстенсивной величиной, то более удобно пользоваться теплоемкостью, отнесенной к единице количества вещества. В зависимости от этого различают удельную (на 1 г или 1 кг массы) и мольную (на 1 моль) теплоемкости. В зависимости от условий нагревания различают – теплоемкость при постоянном объеме, СV (при V = const) и теплоемкость при постоянном давлении, Теплоемкости зависят от природы вещества, а также от температуры.
Истинная теплоемкость – теплоемкость при заданной температуре
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 860; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.181.81 (0.019 с.) |
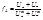 ….
…. 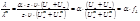
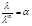
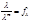

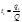 *Число переноса ионов i-го вида – отношение количества электричества qi, перенесенного данным видом ионов, к общему количеству электричества Q, перенесенному всеми ионами, находящимися в растворе:
*Число переноса ионов i-го вида – отношение количества электричества qi, перенесенного данным видом ионов, к общему количеству электричества Q, перенесенному всеми ионами, находящимися в растворе: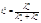
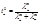 Экстраполяция концентрационной зависимости до с(стрелка)0 дает предельные числа переноса:
Экстраполяция концентрационной зависимости до с(стрелка)0 дает предельные числа переноса: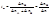
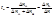 *Метод Гитторфа
*Метод Гитторфа
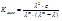
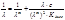
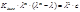 (приводим к общему знаменателю и делим на λ∙(λ∞)2∙Kдисс), получим:
(приводим к общему знаменателю и делим на λ∙(λ∞)2∙Kдисс), получим: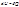
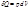
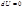 Для идеального газа, а также для реального газа при невысоких давлениях внутренняя энергия является функцией только температуры. Для 1 моль газа:
Для идеального газа, а также для реального газа при невысоких давлениях внутренняя энергия является функцией только температуры. Для 1 моль газа:
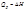 Изобарный процесс (dp =0)
Изобарный процесс (dp =0)
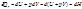

 Средняя теплоемкость – теплоемкость в заданном температурном интервале (от Т1 до Т2):
Средняя теплоемкость – теплоемкость в заданном температурном интервале (от Т1 до Т2):