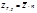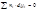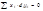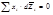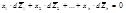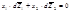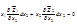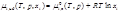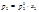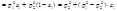Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Парциальные молярные свойства. Уравнение Гиббса-Дюгема
Г. Льюис назвал парциальной молярной величиной компонента частную производную от какой-либо экстенсивной величины g по числу молей этого компонента раствора при постоянных давлении, температуре и числах молей остальных компонентов 1.Парциальное молярное свойство чистого вещества представляет собой свойство, отнесенное к единице количества вещества, т.е. удельное свойство
Физический смысл парциального молярного свойства: оно физически выражает изменение соответствующего экстенсивного свойства в результате добавления при постоянных температуре и давлении 1 моль вещества к столь большому количеству, что состав системы фактически остается неизменным Химический потенциал – это парциальная молярная энергия Гиббса 2.Уравнение Гиббса-Дюгема. При p, T = const: где xi – мольнодолевая концентрация i-го компонента
Парциальные молярные свойства. Уравнение Гиббса-Дюгема для растворов:
Для бинарного раствора:
1)Производные и имеют обратные знаки, т.е. если при изменении x2 парциальная мольная величина одного из компонентов увеличивается, то для другого компонента она уменьшается. 2)При x1 = x2 = 0.5 наклоны кривых Ž i = f (х2) для обоих компонентов одинаковы по абсолютной величине, но отличаются по знаку 3)Если одна из кривых имеет максимум, то другая кривая при том же составе имеет минимум Термодинамические свойства идеальных растворов. Закон Рауля. Температура кипения идеального раствора. Температура замерзания идеального раствора. 1. Термодинамические свойства идеальных растворов Идеальным считается такой раствор, в котором для каждого компонента при всех значениях давления (p), температуры (T) и мольной доли (xi) справедливо выражение зависимости химического потенциала компонента в этом растворе
Термодинамические характеристики образования идеального раствора показывают, что в этом процессе энергия Гиббса уменьшается, энтропия возрастает, а энтальпия, теплоемкость, внутренняя энергия и объем не меняются. Только при одновременном выполнении всех этих условий раствор является идеальным Закон Рауля(продолжение 2) При постоянной температуре давление пара растворителя над раствором было пропорционально его мольной доли в растворе
Для бинарных растворов:
Относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества Если бинарный (идеальный) раствор состоит из двух летучих компонентов, а пар обладает свойствами идеального газа, то закон Рауля справедлив как для растворителя, так и для растворенного вещества:
Общее давление пара над идеальным раствором равно сумме парциальных давлений пара отдельных компонентов
|
|||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 134; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.26.246 (0.004 с.) |