
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Третье начало термодинамики.
Третий закон термодинамики – постулат, который определяет начало отсчета энтропии как функции состояния Утверждения III закона термодинамики согласуются со статистическим толкованием энтропии – абсолютный нуль температуры есть предельное состояние макроскопических тел с установившейся в них наивысшей внутренней упорядоченностью Для реальных тел возможны нарушения кристаллической решетки, в связи с чем энтропия твердого тела даже при абсолютном нуле будет больше нуля. Однако эти отличия невелики, и с достаточной для практических расчетов точностью можно считать энтропию равной нулю. Изменение энтропии вещества при переходе от нуля до некоторой температуры T равно ΔS = SТ – S0, но поскольку S0 = 0, то SТ = Δ S, и задача определения ST сводится к расчету изменений энтропии В справочных таблицах термодинамических свойств веществ обычно приводится величина S298 (S0(298)) – стандартная энтропия при 298 К и p = 1,013∙105 Па. Химическое равновесие. Уравнение изобары. Уравнение изотермы. Закон действующих масс. Химическое равновесие в гетерогенных системах. 1.Химическое равновесие - состояние химической системы, которое характеризуется неизменностью состава и где обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре «прямая - обратная реакция» равны между собой Химическое равновесие является динамическим и подвижным, изменение внешних условий смещает это равновесие в ту или другую сторону В изолированной системе о направленности самопроизвольного процесса судят по изменению энтропии в системе, а в закрытой – по величине полезной работы (работы немеханических сил) Максимальная полезная работа химической реакции – это немеханическая работа, которую силы, заставляющие вещества взаимодействовать, способны произвести, в условиях равновесного процесса
В химической реакции
Для всех участников реакции отношения dnі/νі одинаковы и могут быть представлены в форме дифференциала некоторой величины ξ (кси), которую называют химической переменной (степенью протекания реакции, числом пробегов реакции )
Уравнение изотермы
Уравнение изотермы:
Уравнение изобары (изохоры)
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 63; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.65.65 (0.005 с.) |
|||||||||||||||||||||||||||||
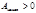 Условие самопроизвольного процесса в замкнутой (закрытой) системе:
Условие самопроизвольного процесса в замкнутой (закрытой) системе: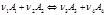
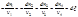 изменения числа молей dn і, участвующих в реакции веществ пропорциональны стехиометрическим коэффициентам уравнения реакции, взятым со знаком минус для исчезающих веществ и со знаком плюс – для образующихся:
изменения числа молей dn і, участвующих в реакции веществ пропорциональны стехиометрическим коэффициентам уравнения реакции, взятым со знаком минус для исчезающих веществ и со знаком плюс – для образующихся: В случае, если p,T=const и ξ=1, а относительные парциальные давления в реакционной смеси равны pi’ (неравновесная система) справедливо:
В случае, если p,T=const и ξ=1, а относительные парциальные давления в реакционной смеси равны pi’ (неравновесная система) справедливо:
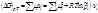
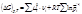


 Изобары Изохоры
Изобары Изохоры


