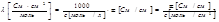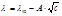Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Функции смешения реальных растворов ⇐ ПредыдущаяСтр 10 из 10
*Для неидеальных систем используют парциальные молярные функции смешения * Парциальная молярная энергия Гиббса смешения:
Парциальная молярная энтальпия смешения:
Парциальный мольный объем смешения:
Парциальная молярная энтропия смешения равна:
4.Методы определения активностей *Методы определения активностей растворителя 1.По давлению пара растворителя над раствором:
2.По повышению температуры кипения раствора:
3.По понижению температуры замерзания раствора:
4.По осмотическому давлению раствора
*Методы определения активностей растворенного вещества 1.По давлению пара растворенного вещества над раствором: 2.По активности растворителя: 3.По коэффициенту распределения растворенного вещества между двумя несмешивающимися жидкостями: 4. Неравновесные явления в электролитах, основные понятия. Законы Фарадея. Молярная электрическая проводимость сильных и слабых электролитов. Удельная электрическая проводимость сильных и слабых электролитов. Зависимости æ и λ от концентрации и температуры. 1.Неравновесные явления в электролитах. Фарадей: Так как прохождение электрического тока через электрохимическую систему связано с химическими превращениями, то между количеством прошедшего электричества и количеством прореагировавших веществ существует связь. I закон Фарадея: количества веществ, превращенных при электролизе, пропорциональны количеству электричества, прошедшего через электролит
где Δm – масса вещества, которое прореагировало, Q – количество электричества, равное произведению силы тока I на время t, II закон Фарадея: при прохождении одного и того
Для электрохимического превращения 1 моль∙экв любого вещества требуется одинаковое количество электричества F, называемое постоянной Фарадея. Постоянная Фарадея составляет 96 485 Кл/моль∙экв, или 26.8 А∙ч/моль∙экв. Уравнение, объединяющее оба закона Фарадея:
(Продолжение 4)
2.Молярная электрическая проводимость (λ) – это мера электрической проводимости всех ионов, образующихся при диссоциации 1 моль электролита при данной концентрации. λ численно равна электрической проводимости объема V (м3 или см3) раствора, заключенного между двумя параллельными электродами, с межэлектродным расстоянием 1 м (1 см), причем каждый электрод имеет такую площадь, чтобы в этом объеме содержалось 1 моль растворенного вещества. Связь удельной (См/см) и молярной (См∙см2/моль) проводимости:
*Молярная электрическая проводимость электролитов с увеличением концентрации уменьшается. *В растворах сильных электролитов при увеличении концентрации усиливается межионное взаимодействие и скорость движения ионов при этом уменьшается. ~Число ионов в разбавленных растворах при этом не изменяется, так как для определения молярной электрической проводимости всегда берется такой объем раствора, в котором находится 1 моль электролита. ~При значительных концентрациях возможна ионная ассоциация, приводящая к уменьшению числа токопроводящих частиц. *В случае слабых электролитов при возрастании концентрации уменьшается степень диссоциации, и число ионов в объеме раствора уменьшается и молярная электрическая проводимость падает. *Уравнение Кольрауша: в области разбавленных растворов молярная электрическая проводимость линейно уменьшается с увеличением корня квадратного из концентрации: где λ∞ – предельная молярная электрическая проводимость, т.е. электрическая проводимость при бесконечном разведении (λ®λ∞ при c®0), 3.Удельная электрическая проводимость æ равна электрической проводимости проводника с единичными размерами (S = 1, l = 1), ее выражают в Ом–1м–1 или См/м (См – Сименс). *Для растворов электролитов æ выражают в См/см, т.е. æ представляет электрическую проводимость 1 см3 раствора, помещенного между плоскими параллельными электродами, находящимися на расстоянии 1 см друг от друга.
*Удельная электрическая проводимость зависит от природы электролита и растворителя, температуры, концентрации электролита. *При постоянных температуре и напряженности электрического
|
||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 138; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.142.146 (0.006 с.) |
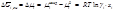
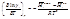
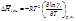
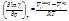
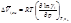
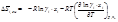
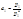
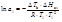
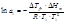
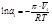
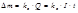
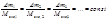
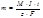 где М – молярная масса вещества; I – сила тока;
где М – молярная масса вещества; I – сила тока;