
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение содержания связанной о-аминобензойной кислоты методом потенциометрического титрованияСодержание книги
Поиск на нашем сайте
Потенциометрический метод анализа основан на определении разности электродных потенциалов, возникающих между двумя электродами, которые опущены в раствор определенного состава. Величина электродного потенциала зависит от состава и концентрации раствора, от природы электродов, температуры и других факторов. Окончание титрования устанавливают по резкому изменению потенциала индикаторного электрода вблизи точки эквивалентности. Ход анализа. В коническую колбу емкостью 100 мл помещали (0,35±0,01) г (с точностью до 0,0002 г) навеску исследуемого вещества и смачивали 10 мл этанола. Колбу закрывали пробкой и для лучшего набухания образца ставили на 15 минут в термостат, имеющий температуру 56-60 °С. По истечении этого времени в колбу добавляли 10 мл раствора KOH (0,5 моль×л-1) и оставляли до полного омыления на 1 сутки при температуре 55-60 °С. Затем содержимое колбы потенциометрически титровали раствором HCl (0,5моль×л-1); электрод сравнения - хлорсеребряный, индикаторный электрод - стеклянный. Содержание связанной о-АБК вычисляется по формуле:
где С - содержание связанной КК, %;щ - нормальность раствора NaOH;щ - объем раствора NaOH;к - объем соляной кислоты, пошедшей на титрование;к - нормальность соляной кислоты; Э - эквивалентная масса о-АБК; q - масса навески.
2.7 Определение кислых гидроксильных групп в лигнине хемосорбционным методом[
Для определения кислых гидроксильных групп в лигнине используют хемосорбционный метод. Хемосорбционный метод, разработанный для определения кислых гидроксильных групп в нерастворимых высокомолекулярных органических веществах (углях, гуминовых веществах, лигнинах) Т.А. Кухаренко и К.И. Сысковым, не требует сложной аппаратуры и малодоступных реактивов и потому нашел широкое применение. В основе метода лежит ионный обмен между кислыми группами анализируемого вещества и Ва(ОН)2:
После контактирования навески вещества с определенным объемом титрованного раствора Ва(ОН)2 избыток последнего оттитровывают кислотой и по найденному количеству связанного Ва(ОН)2 вычисляют общее количество кислых групп. Ход анализа. В сухую мерную колбу емкостью 25 мл помещают навеску лигнина (40-60 мг), прибавляют точно 5 мл 0,1 н. LiOH и 2 мл 96 %-ного этанола и ставят закрытую колбу на 3 мин в нагретую до 85 °С водяную баню. К горячему раствору или суспензии прибавляют 1 мл 10 %-ного раствора хлорида бария, закрывают колбу и оставляют на 15 мин для охлаждения, после чего смесь доводят до метки прокипяченной дистиллированной водой, перемешивают, быстро переливают в пробирку, которую закрывают крышкой и центрифугируют 3-5 мин. Затем пипеткой отбирают 20 мл прозрачного фугата и выливают в коническую колбу, в которую предварительно налито точно 5 мл 0,1 н. HCl. Прибавляют индикатор и избыток кислоты оттитровывают 0,1 н. LiOH из микробюретки. В идентичных условиях, но без навески лигнина проводят холостой опыт. Расчет содержания ОН-групп, %
где а, ао - объемы 0,1 н. LiOH, израсходованные на титрование в рабочем и холостом опытах соответственно, мл; фактор к титру 0,1 н. LiOH; ,25 -коэффициент пересчета на полный объем; ,7 - масса ОН-групп, эквивалентная 1 мл 0,1 н. LiOH, мг; А- навеска лигнина, мг.
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2020-03-14; просмотров: 128; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.84.239 (0.008 с.) |

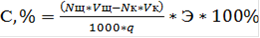
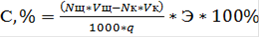 , (2.2)
, (2.2)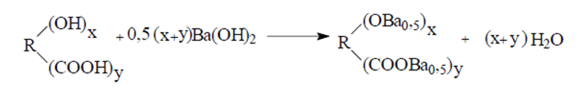
 (2.3)
(2.3)


