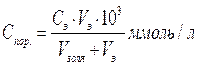Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение и свойства дисперсных систем.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Опыт 1. Получение гидрозоля методом замены растворителя (физическая конденсация). К 10 мл дистиллированной воды добавьте 0,5-1 мл 2% спиртового раствора канифоли (или серы), перемешайте. Получается голубовато-желтый гидрозоль. Направьте на раствор узкий пучок света фонарика, наблюдайте и зарисуйте эффект Тиндаля.
Опыт 2. Получение золя методом гидролиза соли (химическая конденсация). В пробирку налейте 5 мл дистиллированной воды и 0,5-1 мл 2% FeCl3, нагрейте до кипения. Получается красно-коричневый, прозрачный золь гидроксида железа, его мицелла: {Fe(OH)3 ∙n FeO+ ∙(n-x) Cl-}x+ ∙x Cl-.
Опыт 3. Получение золя берлинской лазури (реакция обмена). А) К 1-2 мл 0,001М раствора K4[Fe(CN)6] прибавляют 2-3 капли раствора FeCl3. Получается отрицательный синий золь, его мицелла: {m KFe[Fe(CN)6] ∙ n [Fe(CN)6]4 -∙ (4n-x)K+}x- ∙ xK+. Какой знак заряда у частиц? Б) К 2-3 мл раствора FeCl3 прибавьте 1-2 капли раствора K4[Fe(CN)6]. Получается зеленый золь, его мицелла: {m KFe[Fe(CN)6] ∙ n Fe3+∙ (3n-x)Cl-}x+ ∙ xCl -. Какой знак заряда у частиц?
Опыт 4. Определение знака зарядов коллоидных частиц. При погружении фильтровальной бумаги в воду, бумага приобретает отрицательный заряд. Если каплю коллоидного раствора нанести на фильтровальную бумагу, то при отрицательном заряде частиц происходит пропитывание краской бумаги. При положительном заряде коллоидных частиц происходит разложение раствора на две фазы: дисперсную фазу и дисперсную среду. На этом основано определение знака заряда окрашенных коллоидных частиц. Используйте растворы метиленовой сини и эозина.
Опыт 5. Получение эмульсий. Налейте в пробирку 2-3 мл воды, 2-3 капли углеводорода или растительного масла, встряхните. Устойчивая ли эмульсия? Добавьте в эту же пробирку 1-2 мл раствора мыла, встряхните. Запишите наблюдения. Какова роль мыла в получении эмульсии? Каков тип эмульсии: масло в воде (м/в) или вода в масле (м/в)? Нарисуйте как молекулы мыла адсорбируются на каплях масла.
Опыт 6. Определение порога коагуляции электролитов. В коническую колбу налейте 10 мл гидрозоля Fe(OH)3 и титруйте до появления мути одним из электролитов: 1) 6М NaCl; 2) 0,01M K2SO4; 3) 0,001M K3[Fe(CN)6]. Запишите объем в мл электролита (Vэ), пошедшего на титрование. Рассчитайте порог коагуляции:
где Сэ– молярная концентрация коагулирующего электролита, Vэ - объем (мл) электролита, вызывающего коагуляцию золя объемом Vзоля. Для всех электролитов рассчитайте коагулирующее действие КД = 1/Спор ммоль/л. Результаты запишите в таблицу:
Из полученных данных сделайте вывод о соответствии с правилом Шульце-Гарди: порог коагуляции обратно пропорционален заряду коагулирующего иона в шестой степени.
Контроль усвоения темы занятия. Типовой тест выходного контроля. 1. Минимальная концентрация электролита, вызывающая коагуляцию золя. 1) коагулирующее действие 2) порог коагуляции 3) молярность 4) ККМ-критическая концентрация мицеллообразования. 2. Золь AgJ получен при добавлении избытка раствора NaJ к раствору AgNO3 . Какой ион будет потенциалопределяющим? 1) Ag+ 2) Na+ 3)J- 4) NO3 - 3. Коллоидные ПАВ 1) NaCl 2) C2HsOH 3) мыло 4) фосфолипиды. 4. Ион, имеющий наибольшее коагулирующее действие по отношению к золяю слюны: {m Ca3(P04)2 ∙ nHPO42- (n-x)Ca2+}x-∙хСа2+ 1) Na+ 2) CI- 3)Ca +2 4)Fe3+ 5) SO4 2- 6)F-. 5. Явление, при котором усиливается коагулирующее действие одного иона в присутствии другого иона 1) антагонизм 2)синергизм 3) взаимная коагуляция 4)аддитивность Типовые задачи. 1. Золь гексацианоферрата (II) меди получен при действии на соль меди (II) избытком гексацианоферрата (II) калия. Написать формулу мицеллы золя. 2. Золь кремневой кислоты получили при взаимодействии K2SiO3 и HCl. Какой из электролитов был в избытке, если в электрическом поле гранулы перемещаются к аноду? Напишите формулу мицеллы золя. 3.Напишите формулу мицеллы золя золота, стабилизированного KAuO2. У какого из электролитов: NaCl, BaCl2, FeCl3 порог коагуляции наименьший? 4.Напишите формулы золей: АgJ,стабилизированного AgNO3; и Fe(OH)3 стабилизированного FeCl3. Как заряжены частицы этих золей 5. Бактерии и вирусы по своим размерам близки к коллоидным частицам. Исходя из известных вам свойств коллоидных растворов укажите: какими способами можно очистить воду от бактерий? 6. Какой объем 0,001 М раствора FeCl3 надо добавить к 0,03 л 0,002 М раствора AgNO3, чтобы частицы золя AgCl в электрическом поле двигались к аноду? Напишите формулу мицеллы золя. (Ответ: больше 60 мл). 7. Коагуляция золя сульфида золота объемом 1,5 л наступила при добавлении 570 мл раствора хлорида натрия с концентрацией 0,2 М. Вычислите порог коагуляции золя ионами натрия. (Ответ: 55ммоль/л). 6. Пороги коагуляции золя Fe(OH)3 сульфатом натрия и хлоридом калия соответственно равны 0,32 и 20,5 ммоль/л. Определите знак заряда коллоидных частиц золя, вычислите коагулирующее действие этих электролитов, проверьте, выполняется ли правило Шульце-Гарди. 7.Вычислите удельную поверхность золя 1 кг угольной пыли с диаметром частиц 10-3 м. Плотность угля ρ=1,8∙103 кг/м3. 8. Сравните интенсивность светорассеяния высокодисперсного полистирола, освещенного монохроматическим светом с длинной волны λ =680 нм, а затем с λ2 =420 нм. 9. Определите осмотическое давление гидрозоля золота концентрации С=2 кг/м3 с диаметром частиц d=6∙10-9 м и плотностью ρ=19,3∙103 кг/м3,Т=293К. 10. Сравните осмотическое давление двух гидрозолей, отличающихся дисперсностью: r1=30 нм, r2=55 нм. 11. С какой скоростью будут оседать капли водяного тумана с радиусом частиц r=10-4 м. Вязкость воздуха η=1,8∙10-5 н∙с/м2. Плотностью воздуха пренебречь. 12. Вычислите средний сдвиг коллоидных частиц золя Fe(OH)3, при 293 К за время t=4 с, если радиус частиц r=10-8 м, вязкость воды η=10-3 н∙с/м2. 13. Вычислите коэффициент диффузии мицелл мыла в воде при 313 К и радиусе мицелл r=1,25∙10-8м, вязкость воды η=6,5∙104 н∙с/м2, постоянная Больцмана k=1,33∙10-23 Дж/град. 14. Порог коагуляции положительно заряженного гидрозоля Fe(OH)3 под действием раствора NaCl равен 9,25 ммоль/л. Рассчитайте пороги коагуляции для KNO3, BaCl2, K2SO4, MgSO4, K2Cr2O7, пользуясь правилом Шульце-Гарди.
УИРС. Диализ.
Равные объемы 0,5% раствора крахмала и 0,1М НС1 налейте в диализатор, который погрузите на 20-30 минут в сосуд с дистиллированной водой. Затем проверьте воду, в которую был погружен диализатор на наличие крахмала (в пробирку добавьте 2-3 капли раствора J2), и кислоты НС1 (в пробирку добавьте индикатор метилоранж или универсальный). Сделайте вывод об отличии растворов ВМС или коллоидов от истинных растворов низкомолекулярных соединений по способности проходить через полупрницаемые мембраны.
Подведение итогов занятия. 9. Задание на дом. Свойства растворов высокомолекулярных соединений. Место проведения самоподготовки: читальный зал и др. Литература. [ 1 ],[ 3 ], [ 4 ].
Занятие №12
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 1860; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.8.177 (0.006 с.) |