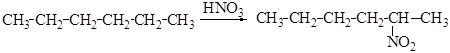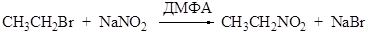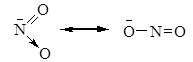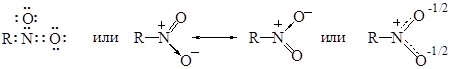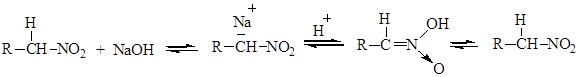Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы получения нитроалкановСодержание книги
Поиск на нашем сайте
АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ Лекция №24 НИТРОСОЕДИНЕНИЯ АЛИФАТИЧЕСКОГО РЯДА Алифатические нитросоединения. Химические свойства Гомологический ряд. Изомерия, номенклатура. Способы получения: нитрование алканов, из галогеналканов (реакция Мейера). Получение нитросоединений окислением аминогруппы. Строение нитросоединений. Таутомерия нитросоединений. Реакции по a-углеродному атому: реакции со щелочами, карбонильными соединениями. Строение солей. Реакции по нитрогруппе. Восстановление, действие минеральных кислот. Нитрометан, получение, применение в технике. Полинитросоединения. Нитроалканы имеют общую формулу CnH2n+1NO2 или R-NO2. Им изомерны алкилнитриты (эфиры азотной кислоты) с общей формулой R-ONO. Изомерия нитроалканов связана с изомерией углеродного скелета. Различают первичные RCH2NO2, вторичные R2CHNO2 и третичные R3CNO2 нитроалканы, например:
Номенклатура Заоснову названия нитроалканов берут название углеводорода с приставкой нитро- (нитрометан, нитроэтан и т.д.). По систематической номенклатуре положение нитрогруппы обозначается цифрой:
Способы получения нитроалканов Нитрование алканов азотной кислотой (Коновалов, Хэсс) Концентрированная азотная кислота или смесь азотной и серной кислот окисляют алканы. Нитрование протекает только под действием разбавленной азотной кислоты (уд.вес 1,036) в жидкой фазе при температуре 120-130°С в запаянных трубках (М.И. Коновалов, 1893г.): R-H + HO-NO2 → R-NO2 + H2O Для нитрования Коновалов М.И. впервые использовал нонафтен
Было установлено, что легкость замещения водородного атома нитрогруппой растет в ряду:
Основными факторами, влияющими на скорость реакции нитрования и выход нитросоединений, являются концентрация кислоты, температура и продолжительность процесса. Так, например, нитрование гексана проводят азотной кислотой (d 1,075) при температуре 140°С:
Реакция сопровождается образованием полинитросоединений и продуктов окисления. Практическое значение получил метод парофазного нитрования алканов (Хэсс, 1936 г.). Нитрование проводят при температуре 420°С и непродолжительном пребывании углеводорода в реакционной зоне (0,22-2,9 сек). Нитрование алканов по Хэссу приводит к образованию смеси нитропарафинов:
Образование нитрометана и этана происходит в результате крекинга углеводородной цепи. Реакция нитрования алканов протекает по свободнорадикальному механизму, причем азотная кислота не является нитрующим агентом, а служит источником окислов азота NO2:
Реакция Мейера (1872) Взаимодействие галоидных алкилов с нитритом серебра приводит к получению нитроалканов:
Способ получения нитроалканов из галоидных алкилов и нитрита натрия в среде ДМФА (диметилформамида) предложен Корнблюмом. Реакция протекает по механизму SN2.
Наряду с нитросоединениями в реакции образуются нитриты, это связано с амбидентностью нитрит-аниона:
Строение нитроалканов Нитроалканы могут быть изображены октетной формулой Льюиса или резонансными структурами:
Одна из связей атома азота с кислородом называется донорно-акцепторной или семиполярной. Физические свойства Нитросоединения жирного ряда – жидкости, обладающие приятным запахом, они мало растворимы в воде, ядовиты, не вызывают коррозии металлов. В таблице 24.1 приведены температуры кипения, плотность и показатель преломления наиболее распространенных нитропарафинов. Нитросоединения – полярные вещества; их дипольные моменты 3,5-4,0 D. Таблица 24.1 Физические свойства нитроалканов
* т. пл. Химические свойства Химическиепревращения нитроалканов связаны с реакциями по a-водородному атому углерода и нитрогруппе. К реакциям по a-водородному атому следует отнести реакции со щелочами, с азотистой кислотой, альдегидами и кетонами. Образование солей Нитросоединения относятся к псевдокислотам – они нейтральны и не проводят электрический ток, однако взаимодействуют с водными растворами щелочей с образованием солей, при подкислении которых образуется аци-форма нитросоединения, самопроизвольно изомеризующаяся затем в истинно нитросоединение:
Способность соединения существовать в двух формах называется таутомерией. Анионы нитроалканов – амбидентные анионы, обладающие двойственной реакционной способностью. Строение их может быть представлено следующими формами:
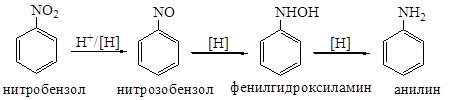
Отдельные представители Практическая значимость нитросоединений очень высока, несмотря на их токсичность. Они применяются как исходные соединения для получения аминов, взрывчатых веществ, топлива для реактивных двигателей, как растворители, промежуточные продукты для синтеза лекарственных препаратов, красителей. Нитрометан применяют как однокомпонентное ракетное топливо, а также в производстве хлорпикрина и нитроспиртов. Он находит применение как растворитель для восков и жиров, как экстрагент ароматических углеводородов. Обладает наркотическим действием. Трихлорнитрометан (хлорпикрин) применяется как пестицид и в синтезе арилметановых красителей. Сильный лакриматор. Лекция №25. Ароматические нитросоединения. Химические свойства Изомерия, номенклатура. Способы получения: нитрование бензола и его гомологов (нитрование в ядро и в боковую цепь). Механизм реакции нитрования, ориентация в ароматическом ядре. Химические свойства. Восстановление нитросоединений в кислой, нейтральной и щелочной средах. Практическое значение этих реакций. Активирующее влияние нитрогруппы на реакции нуклеофильного замещения. Полинитросоединения ароматического ряда. Химические свойства Химические свойства нитросоединений ароматического ряда обусловлены наличием в молекуле нитрогруппы и ароматического ядра. Восстановление Впервые нитробензол был восстановлен до анилина с помощью сернистого аммония в 1842 г. Н.Н. Зининым. Это открытие сыграло важнейшую роль в развитии химической технологии, особенно в химии красителей, медикаментов и фотохимикатов. Было установлено, что восстановление ароматических нитросоединений в ароматические амины происходит в несколько стадий и что его течение зависит от рН среды. В нейтральной и кислой среде конечными продуктами восстановления являются ароматические амины, причем в кислой среде промежуточные продукты выделить не удается, а в нейтральной можно выделить нитрозобензол и фенилгидроксиламин:
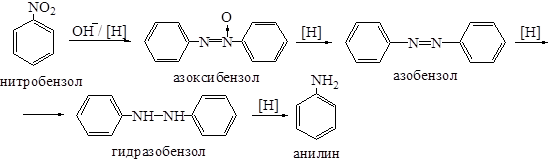
В щелочной среде нитро- и нитрозобензолы конденсируются с фенилгидроксиламином и образуются азоксибензол, азобензол и гидразобензол:
Важным фактором при восстановлении ароматических нитросоединений является сила восстанавливающего агента:
Различные продукты восстановления можно получать, пользуясь методом электрохимического восстановления, в зависимости от потенциала на электродах можно получать различные вещества. Особое значение в настоящее время играет каталитическое восстановление нитросоединений. Так, восстановление водородом в присутствии катализатора было проведено в 1872 году М.М. Зайцевым. Для превращения нитробензола в анилин смесь паров нитробензола с водородом пропускают через трубку с палладиевой чернью при температуре 150°С. Наиболее подходящим катализатором восстановления является медь. Метод каталитического восстановления нитробензола водородом используют в промышленном масштабе. Отдельные представители Нитробензол (т. кип 210°С) получают нитрованием бензола. В чистом состоянии – бесцветная жидкость с запахом горького миндаля. Не растворим в воде. Тяжелее воды, ядовит. Является растворителем для некоторых веществ. Применяется почти исключительно в производстве анилина. Тринитробензол получают с низким выходом при нитровании бензол. Обычный путь получения – окисление и декарбоксилирование тринитротолуола. Т пл. 172°С. Сильное, но малодоступное взрывчатое вещество. Нитротолуолы получают нитрованием толуола. Нитротолуолы - кристаллические вещества. Нитротолуолы применяются для получения толуидинов – важных полупродуктов в производстве красителей. Тринитротолуол (тротил, тол) получают нитрованием толуола. Желтые кристаллы. Т. пл. 80,6°С. Важнейшее взрывчатое вещество.
АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ Лекция №24 НИТРОСОЕДИНЕНИЯ АЛИФАТИЧЕСКОГО РЯДА Алифатические нитросоединения. Химические свойства Гомологический ряд. Изомерия, номенклатура. Способы получения: нитрование алканов, из галогеналканов (реакция Мейера). Получение нитросоединений окислением аминогруппы. Строение нитросоединений. Таутомерия нитросоединений. Реакции по a-углеродному атому: реакции со щелочами, карбонильными соединениями. Строение солей. Реакции по нитрогруппе. Восстановление, действие минеральных кислот. Нитрометан, получение, применение в технике. Полинитросоединения. Нитроалканы имеют общую формулу CnH2n+1NO2 или R-NO2. Им изомерны алкилнитриты (эфиры азотной кислоты) с общей формулой R-ONO. Изомерия нитроалканов связана с изомерией углеродного скелета. Различают первичные RCH2NO2, вторичные R2CHNO2 и третичные R3CNO2 нитроалканы, например:
Номенклатура Заоснову названия нитроалканов берут название углеводорода с приставкой нитро- (нитрометан, нитроэтан и т.д.). По систематической номенклатуре положение нитрогруппы обозначается цифрой:
Способы получения нитроалканов
|
||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 1861; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.209.107 (0.011 с.) |