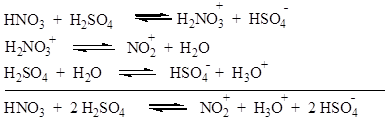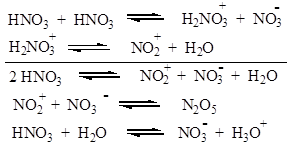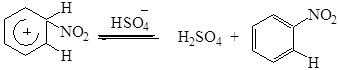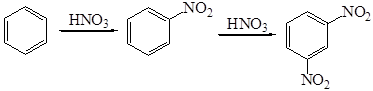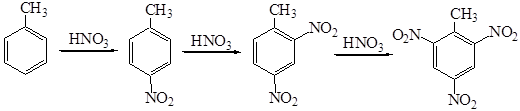Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение ароматических нитросоединенийСодержание книги
Поиск на нашем сайте
Нитросоединения с нитрогруппой в ядре получают нитрованием ароматических углеводородов азотной кислотой, смесью азотной и серной кислот (нитрующая смесь), а также смесью азотной кислоты с уксусной, уксусным ангидридом, солями нитрония (NO2BF4, NO2ClO4 и др.):
Нитрующим агентом является нитроний-катион (NO2)+, образование которого в смеси азотной и серной кислот описывается следующими уравнениями:
В азотной кислоте образование нитроний-катиона происходит в результате автопротолиза:
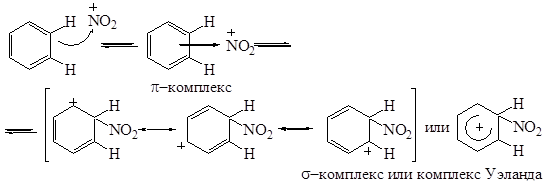
Механизм реакции нитрования ароматических соединений подробно изучен. Взаимодействие с нитроний-катионом ароматического соединения протекает через π- и σ-комплексы:
В отрыве протона участвует гидросульфат-анион.
Реакция нитрования существенно зависит как от строения ароматического соединения (субстрата), так и состава нитрующей смеси и ее количества. Так, при нитровании нитробензола вторая нитрогруппа вступает в м -положение и для её введения необходимы жесткие условия нитрования: концентрированная кислота, высокая температура. Максимальная скорость нитрования нитробензола в м -динитробензол достигается в 90%-ной серной кислоте, снижение концентрации до 80% снижает скорость реакции в 3000 раз:
Третья нитрогруппа вводится в молекулу 1,3-динитробензола с еще большим трудом с образованием 1,3,5-тринитробензола. В то же время толуол нитруется до тринитротолуола в более мягких условиях, чем бензол. При нитровании толуола образуются три изомера о-, м - и п- нитротолуолы:
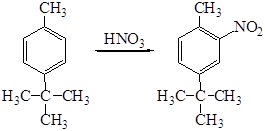
Состав изомеров при нитровании зависит не только от электронодонорного характера группы (NН2, СН3), но и объема заместителя (стерическое влияние). При нитровании гомологов бензола, содержащих 2 заместителя, замещение на нитрогруппу происходит рядом с заместителем меньшего объема:
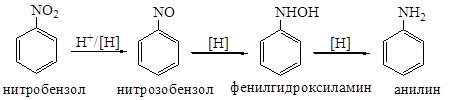
НИТРОСОЕДИНЕНИЯ С НИТРОГРУППОЙ В БОКОВОЙ ЦЕПИ (ЖИРНОАРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ) Нитросоединения с нитрогруппой в боковой цепи получают теми же методами, что и нитросоединения жирного ряда: 1. Нитрование гомологов бензола разбавленной азотной кислотой (реакция Коновалова) - см. Лекцию№24. Ar-CH3 + HONO2 → Ar-CH2NO2 + H2O 2. Реакция галогенпроизводных с галогеном в боковой цепи с нитритом серебра (реакция Мейра) C6H5-CH2Cl + AgNO2 → C6H5-CH2NO2 + AgCl Химические свойства Химические свойства нитросоединений ароматического ряда обусловлены наличием в молекуле нитрогруппы и ароматического ядра. Восстановление Впервые нитробензол был восстановлен до анилина с помощью сернистого аммония в 1842 г. Н.Н. Зининым. Это открытие сыграло важнейшую роль в развитии химической технологии, особенно в химии красителей, медикаментов и фотохимикатов. Было установлено, что восстановление ароматических нитросоединений в ароматические амины происходит в несколько стадий и что его течение зависит от рН среды. В нейтральной и кислой среде конечными продуктами восстановления являются ароматические амины, причем в кислой среде промежуточные продукты выделить не удается, а в нейтральной можно выделить нитрозобензол и фенилгидроксиламин:
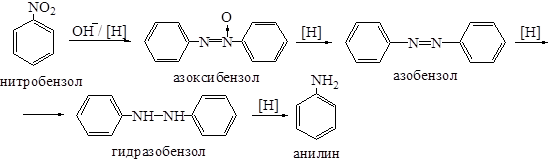
В щелочной среде нитро- и нитрозобензолы конденсируются с фенилгидроксиламином и образуются азоксибензол, азобензол и гидразобензол:
Важным фактором при восстановлении ароматических нитросоединений является сила восстанавливающего агента:
Различные продукты восстановления можно получать, пользуясь методом электрохимического восстановления, в зависимости от потенциала на электродах можно получать различные вещества. Особое значение в настоящее время играет каталитическое восстановление нитросоединений. Так, восстановление водородом в присутствии катализатора было проведено в 1872 году М.М. Зайцевым. Для превращения нитробензола в анилин смесь паров нитробензола с водородом пропускают через трубку с палладиевой чернью при температуре 150°С. Наиболее подходящим катализатором восстановления является медь. Метод каталитического восстановления нитробензола водородом используют в промышленном масштабе.
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 341; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.65.111 (0.007 с.) |