
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кристаллы. Связи между атомами и молекулами в твердых телахСодержание книги
Поиск на нашем сайте
Каждая частица в кристаллической решетке (ион, атом или молекула) испытывает силы межмолекулярного взаимодействия. Равновесное расположение всех частиц твердого тела в узлах кристаллической решетки соответствует минимуму свободной энергии кристалла и наиболее устойчивому его состоянию. При этом частицы в узлах решетки располагаются на некоторых равновесных расстояниях
 . В ней чередуются ионы . В ней чередуются ионы  и и 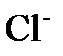 . В газообразном состоянии хлористый натрий состоит из молекул, в которых объединены попарно ионы натрия с ионами хлора. В кристалле молекулы утрачивают обособленное существование. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу. . В газообразном состоянии хлористый натрий состоит из молекул, в которых объединены попарно ионы натрия с ионами хлора. В кристалле молекулы утрачивают обособленное существование. Ионный кристалл состоит не из молекул, а из ионов. Весь кристалл в целом можно рассматривать как одну гигантскую молекулу.
В узлах молекулярной решетки (см. рис. 35.2) размещаются полярные молекулы. Разноименно заряженные частицы двух соседних молекул притягиваются и связывают молекулы в кристаллическую решетку. Таким образом, между молекулами кристалла действуют те же силы, что и между молекулами реального газа. Эти силы называют еще силами Ван-дер-Ваальса. По сравнению с ионными, молекулярные решетки не такие прочные, они легко деформируются. Такие решетки имеют вода (лед), углекислота (сухой лед), азот, кислород, водород, а также резина, парафин, целлюлоза и многие другие кристаллы. В атомных решетках нейтральные атомы соседних узлов связаны между собой валентными электронами. Орбиты электронов смещаются так, что электрон движется по орбите, охватывающей два соседних атома, и таким образом, связывает их между собой. Так осуществляется связь атомов в молекулах с ковалентной связью.
 и кремний и кремний  . .Кристаллическая решетка графита (см. рис. 35.4) имеет совершенно другое строение. Она состоит из ряда параллельных слоев атомов. Каждый слой заполнен тесно связанными между собой атомами углерода, размещенными в вершинах правильного шестиугольника на расстоянии 142 пм друг от друга. Между соседними атомами, лежащими в одном слое, осуществляется прочная валентная связь Атомы соседних слоев слабо связаны друг с другом, так как расстояние между соседними слоями более чем вдвое превышает расстояние между атомами шестиугольника и равняется 340 пм. В этом направлении связь осуществляется слабыми силами Ван-дер-Ваальса. Поэтому кристалл графита легко скалывается вдоль этих слоев (плоскостей спайности), он мягок и легко крошится. Это позволяет изготовлять из графита грифели карандашей, щетки электродвигателей, сухие смазки, используемые, например, для уменьшения трения между листами рессоры автомобиля. Поскольку лишь три валентных электрона атома углерода из четырех принимают участие в образовании валентных связей с соседними атомами, четвертый электрон оказывается слабо связанным с атомом. Именно такие электроны обеспечивают электропроводность графита, тогда как алмаз не является проводником электрического тока.
|
||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 240; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.92.98 (0.01 с.) |

 друг от друга, называемых периодом кристаллической решетки.
друг от друга, называемых периодом кристаллической решетки.






