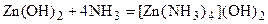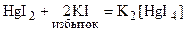Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Низко - и высокоспиновые комплексы.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Ячеек с низкой энергией – три и ион хрома(Cr3+), имея три непарных электрона (d3) займет эти ячейки по правилу Гунда dε dγ Cr3+......4s03d3 €€€ €€ низкая высокая
Но у следующих элементов,у которых больше трех непарных электрона, когда будут заполнены d - ячейки с низкой энергией (dε) тремя электронами, возникнут две альтернативы: - заполнить уже занятую ячейку dε против правила Гунда (это требует затраты энергии Р), - по правилу Гунда заполнить пустую ячейку dγ с высокой энергией. 1) Если ∆ < P (затрат против правила Гунда), электрон пойдет в пустую ячейку dγ, - спин будет высокий. 2) Если ∆ > P, электроны пойдут в уже занятые ячейки c низкой энергией, в результате спаривания электронов спин уменьшится и ион металла будет находится в состоянии с низким спином.
Характеристика ионов в октаэдрическом поле
Вывод: теория кристаллического поля устанавливает количественную взаимосвязь между магнитными и спектральными характеристиками комплексов, что не удается сделать с помощью метода валентных связей.
Образцы решения эадач. Пример 1. Вычислить заряды комплексных ионов, образованных четырехвалентной платиной: 1) [Pt(NH3)4Cl2]; 2) [Pt(NH3)3Cl5] и 3) [Pt(NH3)2Cl4]. Решение. 1) Степень окисления платины равно +4, заряды молекул NH3 равны нулю, а заряды ионов хлора равны – 2; алгебраическая сумма зарядов равна +4 + (–2) = +2; рассуждая подобным образом, найдем заряды других ионов: 2) + 4 + (–5) = –1; 3) +4 + (–4) = 0 В первом случае внешняя сфера содержит отрицательно заряженные ионы. во втором – положительно заряженные ионы, а в третьем – соединение -неэлектролит. Пример 2.. Вычислить концентрацию ионов [Ag+] в 0,01М растворе [Ag(NH3)2]NO3, (Кн = 6,8×10–8). [Ag(NH3)2]+ D Ag+ + 2NH3 Обозначим: [[Ag(NH3)2]+] ≈0,01; [Ag+] = x; [NH3] = 2x Кнест. Пример 3. Вычислить концентрацию ионов [Ag+] в 0,01М растворе [Ag(NH3)]NO3, в присутствии 1моля NH3 (Кн = 6,8×10–8). [Ag(NH3)2]+ D Ag+ + 2NH3 x 1 + 2x ≈ 1 Обозначим [Ag+] = x, тогда [NH3] =2x. Так как 2x< 1, то примем 1+2x~1
Кнест.
Пример 4. Энергия расщепления комплексного иона [Ti(H2O)6]3+ ∆ = 238,3 кДж/моль. Какова окраска соединений Ti3+ в водных растворах? Решение. ∆ = (h c N) /λ; λ = (h c N)/∆ = = 0,4998×10–6 м = 499,8 нм ≈ 500 нм. Поглощаемый свет – Окраска λ = 500 нм зеленый – пурпурно-фиолетовая
Образец тестового опроса Комплексные соединения 1. Укажите название соединения (NH4)2[Fe(NO)(CN)4Cl] 1) хлоротетрацианонитратоферрат(II) аммония; 2) хлорид тетрацианонитроаммин железа(III); 3) хлоротетрацианонитрозоферрат(III) аммония; 4) цианид хлоронитритодиаммин железа(II); 5) хлоротетрацианонитрозодиаммин железа(II). 2. Укажите координационную формулу роданида дицианотетрааммин хрома(III): 1) [Cr(NH3)4(CN)2]CNS; 2) [Cr(NH3)4(CNS)2]CN; 3) [Cr(NH3)3(CN)3]CNS 4) [Cr(NH2)4(CNS)2]CN; 5) Cr[NH4(CN)4(CNS)2]. 3. Укажите более сильную кислоту: H2[PtCl4(OH)2] или H4PtO4 1) обе сильные; 2) H4PtO4; 3) H2[PtCl4(OH)2]; 4) обе слабые. 4. Укажите ионы, преимущественно образующиеся при диссоциации в водном растворе соединения [Cr(NH3)6][Co(CN)6]: 1) Cr3+ + 6NH3 + Co3+ + 6CN–; 2) [Cr(NH3)6]3+ + [Co(CN)6]3– 3) Cr3+ + 6NH3 + [Co(CN)6]3–; 4) [Cr(NH3)6]3+ + Co3+ + 6CN– 5) не диссоциирует. 5. Укажите величину и знак заряда комплексного иона [Cr(NH3)3(CN)2SO4]х: 1) 1+; 2) 3+; 3) 0; 4) 1–; 5) 3–. Контрольные вопросы и упражнения
1. Напишите уравнения реакций, протекающих с образованием комплексных ионов (в скобках указано координационное число в полученном комплексе): 1) роданида кобальта (II) с роданидом аммония (n =4); 2) цианида калия с цианидом никеля (n = 4); 3) хлорида меди (II) с гидроксидом аммония (n = 4); 4) сульфата кадмия с аммиаком (n = 4); 5) иодида серебра с тиосульфаом натрия (n = 2); 6) хлорида кадмия с цианидом калия (n = 4); 2. Зная, что комплексообразователями являются ионы Аg+, Со3+, Сr3+, Рt4+, определите заряд следующих комплексных ионов: [Ag(CN)2]х, [Co(CN)6]х, [Cr(NH3)5Cl]х, [PtCl6]х. 3. Определите заряд комплексообразователя в следующих соединениях: а) [NH4]Br; б)[Cu(NH3)4]SO4; в) K2[PtCl6] 4. Определите координационное число и заряд комплексообразователя в следующих соединениях: 1) [Ag(NH3)2]NO3; 2) [Pt(NH3)4]Cl2; 3) K4[Mo(CN)7]; 4) K3[TaCl8]; 5) K5[ZnF9]; 6) [Cr(H2O)4Cl2]Cl 5. Для следующих комплексных соединений укажите: а) комплексообразователь; б) координационное число комплексообразователя; в) его заряд; г)дать название; д) какие из них являются ацидокомплексами?
1)K2[PtCl6]; 2)[Pt(NH3)4]Cl2; 3) [Cu(NH3)4]SO4; 4) K2[Co(CNS)4; 5) K3[Co(NO2)6] 6. Напишите следующие формулы в виде комплексных соединений: 1) 2KCl·PtCl4 3) Co(CN)3·3KCN 5) CuSO4·4NH3 2) CrCl3·6H2O 4) CuSO4·5H2O 6) HgI2·2KI 7. Напишите уравнения диссоциации на ионы следующих солей и выражения для константы нестоцкости: 1) KMgCl3 4) Na3[Co(NO2)6] 2) Na3[Ag(S2O3)2] 5) [Cr(H2O)4Cl2]Cl 3) K2[Cd(CN)4] 6) [Co(NH3)5](NO2)3 8. Объясните, почему раствор комплексной соли K2[Cd(CN)4] с сероводородом образует осадок, а со щелочью не образует. 9. Определите заряд комплексообразователя, его координационное число и приведите название комплексных соединений: 1) Al[Au(CN)2I2]I3 6) K3[SbBr3Cl3] 2) Ba[Cu(CNS)(CN)3] 7) Na3[V(CNS)6] 3) Cr2[Hg(CNS)2Br2]3 8) Ba[Cr(H2O)2(C2O4)2]2 4) [Mg(NH3)4]Cl2 9) K4[Mo(CN)8] 5) Ca[Al(OH)5H2O] 10) Ba[Pt(NO3)4Cl2] 10. Назовите следующие комплексные соединения 1) [Cr(NH3)6](NO3)3 6) [Rh(NH3)5NO3](ClO4)2 2) [Co(H2O)2(NH3)4]Cl3 7) [Mg(H2O)12][AuCl4]2 3) [Pt(H2O)2(NH3)4]Cl4 8) [Li(NH3)3]Br 4) [Cr(C2O4)(NH3)4]NO3 9) [Cu(NH3)4](BrO3)2 5) [Cr(NH3)3(CNS)3] 10) H2[PtCl4(OH)2] 11. Напишите координационные формулы следующих соединений: 1) гексациано-(II)-феррат железа(III); 2) гексациано-(III)-феррат калия; 3) хлорид тетраммингидроксоплатины (IV); 4) гексанитрито-(III)-кобальтат натрия; 5) тетранитритодиаммин-III-кобальтат калия; 6) тетрабромо-диамминплатина; 7) тетрамминфосфатохром 12. Установите, в каких случаях произойдет взаимодействие между растворами нижеуказанных электролитов: а) K2[HgI4] + KBr; г) К[Аg(СN)2] + К2S2О3; б) K2[HgI4] + KCN; д) K[Ag(CN)2] + NH3; a) [Ag(NH3)2]Cl+ K2S2O3; е) K3[Сu(СN)4] + Нg(NО3)2. Напишите уравнения реакций в молекулярной и ионной форме 13. Константа нестойкости иона [Cd(CN)4]2– составляет 1,4·10–17. Вычислить концентрацию ионов кадмия в 0,1 М растворе К2[Cd(CN)4], содержащем в избытке 0,1 моля KCN в литре раствора. Ответ: 1,4·10–14моль/л. 14. Константа нестойкости иона [Аg(CN)4]– составляет 1·10–21. Вычислить концентрацию ионов серебра в 0,05 М растворе K[Ag(CN)2], содержащем, кроме того,0,01 моля в литре раствора. Ответ: 5·10–19 моль/л. 15. Константа нестойкости иона [Аg(S2O3)2]– составляет 1·10–13. Сколько г серебра содержится в виде ионов в 1 л 0,1 М раствора Na3[Ag(S2O3)2], содержащем, кроме того, 25 г Na2S2O3·5H2O? Ответ: 1·10–10 г. 16. Константа нестойкости иона [Аg(NH3)2]+ составляет 6,8·10–8. Какова концентрация ионов серебра в 0,08 М растворе [Аg(NH3)2]NO3,содержащем, кроме того, 0,8 моля аммиака? Сколько г NaCl можно прибавить к 1 л указанного раствора до начала выпадения нерастворимого AgCl? ПРAgCl равно 1,2·10–10. Ответ: 8,5·10–9 моль/л; 0,82 г. 17. Напишите формулу аквасульфата тетраамминмеди (II), а) объясните, на какие ионы диссоциирует она в водном растворе; напишите выражение константы нестойкости этой соли и приведите ее численное значение; б) с точки зрения метода валентных связей объясните, какую форму будут иметь молекулы этого комплексного соединения; в) с точки зрения теории кристаллического поля рассчитайте окраску этого комплексного соединения, если энергия расщепления Δ=209 кДж·моль-1. 18. С точки зрения метода валентных связей объясните, какую форму имеет ион [Ni(NH3)6]2+,,если известно, что он парамагнитен; 19. Вычислите энергию расщепления d-подуровня комплексного иона [Cu(H2O)4]2+, если для него максимум поглощения видимого света соответствует длине волны 365 нм. 20. Укажите тип гибридизации атомных орбиталей иона Fe2+ и пространственную форму иона [Fe(CN)6]4-, если известно, что он диамагнитен. 21. Объясните, почему ионы Cu+ бесцветны, а ион Cu2+ окрашен. 22. C точки зрения метода валентных связей объяснить, какую форму имеет комплексный ион в соединении [Cu(NH3)4]SO4.
23. Для комплексного иона [Cu(NH3)4]2+ полоса поглощения находится при 3040Å, а для [Cu(H2O)4]2+ – при 3650Å; определить энергию электронных переходов и как изменяется сила поля лигандов при переходе от NH3 к Н2O. 24. Определить тип гибридизации атомной орбитали иона Ni2+ и пространственную структуру комплексного иона [Ni(CN)4]2- если известно, что он диамагнитен. 25. Какова окраска соединений никеля (II) в водных растворах, если для иона [Ni(H2O)4]2+ энергия расщепления равна 180,6 кДж·моль-1? 26. С точки зрения метода валентных связей объясните, диамагнитен или парамагнитен ион [Fe(CN)6]3-. 27. Для комплексного иона [Fe(H2O)6]3+ энергия расщепления d-подуровня иона Fe3+ составляет 933,7 кДж·моль-1. При какой длине волны находится максимум поглощения видимого света этим ионом? 28. Определите пространственную структуру иона [Со(Н2О)6]2+, если известно, что он диамагнитен; 29. Для комплексного иона [Со(Н2О)6]2+ энергия расщепления d-подуровня Δ = 111,4 кДж·моль-1. Укажите, при какой длине волны находится максимум поглощения видимого света ионом Со2+ . 30. Укажите, какова пространственная структура иона [Cu(NH3)4]2+; объяснить его магнитные свойства; 31. Определите, при какой длине волны находится максимум поглощения видимого света ионом [CoF6]3-, если известно, что энергия расщепления d-подуровня Δ = 155,3 кДж·моль-1. 32. Чем объяснить, что углерод не образует комплексных соединений, подобных тем, которые характерны для кремния и германия?
Элементы IB подгруппы Cu, Ag, Au Атомы элементов имеют конфигурацию валентных уровней n s1 (n–1)d10 и проявляют степени окисления: +1 +2 +3 Cu+1 Cu+2 Au+3 Ag+1 Au+1
Физические свойства
Получение. Важнейшими минералами, содержащими медь, являются: халькозин или медный блск Cu2S, халькопирит или медный колчедан CuFeS, малахит (CuOH)2CO3. Руду обогащают, затем подвергают обжигу, плавке, конвертированию и полученную черновую медь далее подвергают огневому, а затем электролитическому рафинированию. Чистая медь – тягучий вязкий металл светло-розового цвета,легко прокатывается в тонкие листы, очень хорошо проводит тепло и электрический ток, уступая в этом отношении только серебру. Серебро встречается в самородном состоянии, но большую часть его получают из его соединений. Самой важной серебряной рудой является серебряный блеск или аргентит Ag2S.
Чистое серебро – очень мягкий, пластичный металл, лучше всех проводит тепло и электрический ток. Из-за мягкости оно применяется преимущественно в виде сплавов с медью, и используется для изготовления ювелирных и бытовых изделий, монет, лабораторной посуды, для покрытий других металлов и радиодеталей для повышения электропроводности и устойчивости к коррозии, для изготовления серебряно-цинковых аккумуляторов. Золото встречается исключительно в самородном состоянии в виде вкраплений в кварц или кварцевый песок. В небольших количествах оно встречается в сульфидных рудах железа, свица и меди. Золото вначале отмывается от измельченного песка, затем связывается цианидом натрия в комплексное соединение, из которого восстанавливается цинком с последующей отмывкой от примесей в разбавленной и концентрированной серной кислоте. Золото – ярко-желтый блестящий металл. Оно ковко, пластично, прекрасный проводник тепла и электричества, уступающий в этом отношении только серебру и меди. Ввиду мягкости оно используется в сплавах с серебром и медью. Химические свойства. Наиболее устойчивы соединения меди (II), серебра (I), золота (III). Соединения Ag (I), кроме комплексных солей, очень неустойчивы, под действием света или нагревания они разлагаются, подвергаясь внутримолекулярному окислению-восстановлению:
Соединения Ag (II) и Ag (III) – очень сильные окислители. Экспериментально доказано, что соединения золота (II) состоят из смеси соединений золота (I) и (III). Металлы подгруппы меди малоактивны, химическая активность уменьшается и кислотные свойства оксидов и гидроксидов усиливаются от меди к золоту.
Например:
Золото по отношению к кислотам очень инертно. Оно растворяется в царской водке с образованием комплексной кислоты тетрахлороаурата (III) водорода H[AuCl4] и в концентрированной селеновой кислоте с образованием селената золота(III) Au2(SO4)3.
При нагревании на воздухе медь образует оксиды: красный Cu2O и черный CuO. Гидроксид меди (II) – нестойкое соединение, при нагревании легко разлагается: Cu(OH)2 = CuO + H2O. Это очень слабое основание, однако, в концентрированных растворахлочей растворяется с образованием купритов Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]. Куприты нестойки и при разбавлении щелочных растворов водой гидролизуются с выделением осадка гидроксида меди (II). Na2[Cu(OH)4] Растворы солей меди (II) на основе сильных кислот имеют кислую реакцию среды в результате гидролиза, при этом образуются основные соли:
Сu2+ +HOH DCuOH+ + H+ Гидроксид серебра неустойчив и при взаимодействии солей серебра со щелочами образуется осадок оксида серебра Ag2O.
Оксиды Ag2O и Au2O имеют основной характер, Au2O3 – амфотерный. Оксид серебра (Ag2O) незначительно растворяется в воде (0,017 г/л) с образованием гидроксида серебра AgOH – довольно сильного основания, поэтому водные растворы солей серебра имеют нейтральную реакцию среды. Гидроксид золота (III) Au(OH)3, называемый также золотой кислотой, обладает амфотерными свойствами. Ему соответствует два ряда солей – простые и комплексные, примерами которых служат AuCl3 и Na[AuCl4].
Ионы меди, серебра и золота обладают высокой окислительной способностью, при восстановлении они выделяются в свободном состоянии. Например: Ag2O + H2O2 = 2Ag + O2 + H2O
Важнейшей особенностью ионов меди, серебра и золота является их склонность к образованию комплексных соединений – гидратов [Cu(H2O)4]SO4, аммиакатов [Ag(NH3)2]Cl, [Cu(NH3)4]SO4, цианидных Благодаря высокой склонности меди и серебра к комлексообразованию, они растворяются в присутствии аммиака в пероксиде водорода. 2Ag + 4NH3 + H2O2 = 2[Ag(NH3)2]OH Золото образует прочные комплексы с галогенид-ионами и цианид-ионами, благодаря чему оно сравнительно легко растворяется в царской водке, в соляной кислоте, насыщенной хлором, в пероксиде водорода в присутствии цианида калия и других комплексообразующих и окисляющих растворителях:
4Au + O2 + 2H2O + 8KCN = 4K[Au(CN)2] + 4KOH 2Au + 3I2 + 2KI= 2K[AuI4] пленка Образцы решения задач Пример 1. Рассчитайте количество йода (моль, г), необходимого для растворения 0,02 г золота в присутствии иодида калия. Уравнение напишите методом ионно-электронного баланса. Укажите окислитель и восстановитель, тип ОВР. Решение. Напишем уравнение реакции, учитывая, что йод в присутствии иодид-иона, растворяет золотую пленку с образованием комплексного иона [AuI4]–. I2 являясь окислителем, восстановится до иодид-иона. Au + I2 + KI= ([AuI4] – + I–)
3 I2 +2е = 2I–
3 I2 + 2Au + 8I– = 6I–+ 2[AuI4] – 3 I2 + 2Au + 2I– = 2[AuI4] –
3I2 + 2Au + 2KI = 2K[AuI4]
Тип ОВР – реакция межмолекулярного окисления – восстановления. Согласно условию задачи нужно растворить 0,02 г золота. Найдем количество молей золота υAu = m/M = 0,02/197 = 1,015·10 -4моль Из уравнения реакции следует, что если в реакцию вступает 2 моля золота, требуется 3 моля I2. Определим количество йода, необходимое для реакции с 1,015·10 -4молями золота. n(I2) = mв-ва = n · Мв-ва = 1,52·10 -4· 253,8 = 0,39 г Ответ: 1,52·10 -4 молей, 0,39 г. Пример 2. Рассчитайте объем газа (л, н.у.), выделившегося в результате растворения 1,08 г серебра в разбавленной азотной кислоте. Уравнение напишите методом ионно-электронного баланса. Укажите окислитель и восстановитель, тип ОВР. Решение. Напишем уравнение реакции, учитывая, что серебро при окислении кислотами переходит в наиболее устойчивую степень окисления +1, а нитрат – ион из разбавленных растворов восстанавливается неактивными металлами до NO. Запишем полуреакции, просуммируем их, допишем недостающие ионы и составим окончательное уравнение: Ag + HNO3 = Ag NO3 + NO
1
3Ag + NO3– + 4Н+ = 3Ag++ NO +2Н2О 3 NO3– 3 NO3–
3Ag + 4HNO3 = 3Ag NO3 + NO + 2Н2О Согласно условию задачи растворено 1,08 г серебра. 1. Находим количество молей серебра: nAg = mв-ва/Мв-ва = 1,08 г / 108 г/моль= 0,01 моль. 2. Исходя из коэффициентов в реакции, и учитывая, что 1 моль газообразного вещества при н.у. занимает объем 22,4 л, найдем объем оксида азота:
Ответ: 0,075 л Пример 3. Объясните, почему раствор нитрата меди (II) имеет кислую реакцию среды, а нитрата серебра (I) - нейтральную. Напишитеуравнения соответствующих реакций. Решение. Сольнитрат меди (II) образована сильной кислотой и слабым основанием. Происходит гидролиз соли по катиону. Форма гидролиза – «ступенчатый», протекает по первой ступени. Образуются основная соль и кислота.
Cu(NO3)2 + H2O D(CuOH)NO3 + HNO3 Что касается нитрата серебра, то эта сольобразована сильной кислотой и сильным основанием и гидролизу не подвергается. Пример 4. Напишитеуравнения реакций, с помощью которых можно осуществить следующие превращения: CuCl2→ Cu(OH)2→ K 2[Cu(OH)4]→ Cu(NO3)2→ Cu→ [Cu(NH3)4](OH)2 1. Cu2+ + 2OH– = Cu(OH)2↓ CuCl2 + 2КОН = Cu(OH)2↓ + 2КCl +3H2O 2. Cu(OH)2 + 2КОН = K 2[Cu(OH)4] конц.
Cu(OH)2 + 2 OH– = [Cu(OH)4]2– 3. K2[Cu(OH)4] + 4HNO3 = Cu(NO3)2 + 2KNO3 + 4H2O [Cu(OH)4]2– + 4H+ = Cu2+ + 4H2O 4. Cu(NO3)2 + Zn = Cu + Zn (NO3)2 Cu2+ + Zn = Cu + Zn2+ 5. Cu + 4NH3 +H2O2 = [Cu(NH3)4](OH)2
Образец тестового опроса Cu, Ag, Au
1. Укажите электронную формулу атома меди: 1) 1s22s22p63s23p64s23d9 2) 1s22s22p63s23p64s23d104p65s2 3) 1s22s22p63s23p64s2 4) 1s22s22p63s23p64s03d10 5) 1s22s22p63s23p64s13d10 2. Укажите продукты реакции взаимодействия меди с концентрированной серной кислотой: 1) CuSO4 + H2S + H2O 4) не взаимодействуют 2) CuSO4 + H2 5) CuO + H2 + H2S 3) CuSO4 + SO2 + H2O 3. Укажите реактив, добавлением которого можно подавить гидролиз сульфата меди (II): 1) NH4Cl 2) H2SO4 3) NaOH 4) KCN 5) CuCl2 4. Укажите, в каком из веществ растворяется золото: 1) HNO3 2) NaOH 3) HCl 4) H2SO4 5) H2SeO4 5. Укажите продукты реакции взаимодействия оксида серебра (I) с водным раствором аммиака: 1) Ag + NH3 + H2O 3) [Ag(NH3)2](OH)2 5) [Ag(NH3)4](OH) 2) [Ag(NH3)2]OH 4) AgOH + O2 + N2
Контрольные вопросы и упражнения 1. Методом ионно-электронного баланса составьте уравнение реакции взаимодействия серебра с пероксидом водорода в присутствии аммиака. Учитывая, что аммиак взят в избытке, а пероксид водорода в количестве, содержащемся в 500 мл 0,1М раствора, рассчитайте количество (моль) растворившегося серебра. Ответ:0,1моль 2. Методом ионно-электронного баланса составьте уравнение реакции взаимодействия меди с пероксидом водорода в присутствии цианида калия. Учитывая, что цианид калия взят в избытке, а пероксид водорода в количестве, содержащемся 100 мл 0,5М раствора, рассчитайте массу (г) растворившейся меди. Ответ: 3,175г. 3. Хлор окисляет золото в присутствии соляной кислоты. Какое соединение при этом получается? Методом ионно-электронного баланса составьте уравнение соответствующей реакции. 4. Почему соединения меди (II) может проявлять и окислительные, и восстановительные свойства? Методом ионно-электронного баланса составьте уравнения реакций, подтверждающих это положение. 5. Селеновая кислота окисляет золото. Методом ионно-электронного баланса составьте уравнение соответствующей реакции. 6. Методом ионно-электронного баланса составьте уравнения реакций растворения серебра: 7. а) в разбавленной азотной кислоте; 8. б) в концентрированной азотной кислоте. 9. Медь получают электролизом раствора сульфата меди. Составьте уравнения соответствующих катодного и анодного процессов. 10. При действии нитрата серебра на раствор хлорида олова (II) в щелочной среде образуется осадок черного цвета. Методом ионно-электронного баланса составьте уравнение соответствующей реакции, учитывая, что двухвалентное олово в щелочной среде окисляется до 4-х валентного с образованием станнат-иона SnO32-. 11. Газ, полученный в реакции меди с концентрированной серной кислотой, поглощен раствором едкого натра. Образовалось 430 мл 0,14М раствора кислой соли. Определите количество (моль) и массу (в граммах) вступившей в реакцию меди. Написать уравнения соответствующих реакций. Ответ: 0,06М, 3,82г. 12. Какие степени окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Привести формулы соответствующих соединений. Охарактеризовать их окислительно- восстановительные возможности. Привести примеры реакций. 13. Иодид калия восстанавливает ионы меди (II) в соединения меди со степенью окисления +l. Составьте ионно-электронный баланс и напишите молекулярное уравнение реакции взаимодействия KI с сульфатом меди. 14. На медь и серебро подействовали концентрированной азотной кислотой, к полученным растворам в одном случае (а) добавили избыток концентрированной щелочи, в другом (б) – избыток раствора аммиака. Напишите уравнения реакций соответствующих превращений в молекулярной и ионной формах. ОВР напишите методом ионно-электронного баланса. Укажите признаки реакций в каждом случае. 15. Золото растворяется в царской водке и в селеновой кислоте, приобретая при этом высшую степень окисления. Напишите уравнения методом ионно-электронного баланса. Назовите все образующиеся соединения. 16. В присутствии влаги и диоксида углерода медь покрывается зеленым налетом. Как называется и каков состав образующегося соединения? Что произойдет, если на него подействовать хлороводородной (соляной) кислотой? Напишите уравнения соответствующих реакций. Окислительно-восстановительную реакцию составьте методом ионно-электронного баланса. 17. Кусок латуни обработали азотной кислотой. Раствор разделили на две части. К одной из них прибавили избыток раствора аммиака, к другой — избыток раствора щелочи. Какие соединения цинка и меди образуются при этом? Напишите уравнения соответствующих реакций. Окислительно-восстановительные реакции составьте методом ионно-электронного баланса. 18. Серебро не взаимодействует с разбавленной серной кислотой, тогда как в азотной разбавленной и концентрированной оно растворяется. Чем это можно обьяснить? Напишите уравнения соответствующих реакций методом ионно-электронного баланса. Рассчитайте объем газа (н.у.) выделившегося при растворении 1,08 г серебра в 2н HNO3. Ответ: 74,7мл. 19. Медь не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно обьяснить? Напишите уравнение соответствующей реакции методом ионно-электронного баланса. Рассчитайте объем газа (н.у.) выделившегося при растворении 6,35 г меди. Ответ: 2,24 л. 20. Составьте уравнения реакций в молекулярной и ионной формах, которые надо провести для осуществления следующих превращений: Ag → АgNO3 → AgCI →[Аg(NН3)2]С1 → AgCI→ Na[Аg(CN)2] → Ag2S 21. При сливании растворов нитрата серебра и цианида калия выпадает осадок, который легко растворяется в избытке KCN. Какое комплексное соединение при этом получается. Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций. 22. Объясните, почему различаются рН растворов нитратов меди и серебра. Напишите уравнения соответствующих реакций в ионной и молекулярной формах.
Элементы IIB подгруппы Zn, Cd, Hg Атомы элементов имеют конфигурацию валентных уровней n s2 (n–1)d10 и проявляют степени окисления Zn и Cd (+2); Hg (+1; +2)
Физические свойства
Минералы - сульфиды: ZnS - цинковая обманка (CdS -сопутствует), HgS – киноварь. Получение. Цинк получаютпутем обогащения руды с последующим обжигом и восстановлением коксом. Другой метод заключается в электролитическом воыелении из сульфата, получаемого обработкой обожженных концентратов серной кислотой. Кадмий получают из отходов цинкового производства путем обработки их серной кислотой с последующим выделением металлического кадмия цинком. Полученный продукт растворяют в серной кислоте и подвергают электролизу. Ртуть получают обжигом руды: HgS + O2 = Hg + SO2
Химические свойства. Химическая активность сверху вниз по подгруппе снижается.В ряду напряжений Zn и Cd находятся левее, а Hg – значительно правее водорода. На воздухе цинк и кадмий покрыты тонким слоем оксида (или гидроксида), предохраняющим их от дальнейшей коррозии. Поэтому, несмотря на то, что эти элементы находятся в ряду напряжений левее водорода, они практически не вытесняют его из воды. Однако, если с них снять оксидную пленку, то они взаимодействуют с водой, выделяя водород: Zn + 2H2O = Zn(OH)2 + H2 В разбавленных растворах соляной и серной кислот цинк растворяется легко, кадмий медленно, а ртуть нерастворима.
Азотная кислота легко растворяет все три металла. Например:
Особенность взаимодействия ртути с азотной кислотой состоит в том, что в зависимости от соотношения кислоты и металла могут получаться как соли окисной
Соли ртути (I) в водных растворах диссоциируют с образованием ионов [Hg2]2+:
Валентность ртути в этих соединениях одинакова и равна 2: NO3 – Hg – NO3 и NO3 – Hg – Hg – NO3 Hg+1 (ион [Hg2]2+) – обладает окислительно – восстановительной двойственностью. Например:
Оксиды и гидроксиды имеют различный характер: Zn(OH)2 – амфотерен, Cd(OH)2 – основной, гидроксиды ртути (I) и (II) неустойчивы и разлагаются на воду и оксиды. Hg2(NO3)2 + 2NaOH = 2NaNO3 + Hg2O↓ + H2O Цинк, гидроксид которого обладает амфотерными свойствами, окисляется водой и другими окислителями (нитраты, хлораты, гипохлориты и др.) в щелочной среде:
В расплавах реакции протекают с образованием цинкатов:
Гидролиз солей цинка и его аналогов протекает ступенчато с образованием основных солей:
Поскольку гидроксид ртути неустойчив, основные соли ртути, образующиеся при гидролизе, содержат не группу
Для ионов
Для ртути характерно образование ацидокомплексов с ионами I –, CNS – и др. в качестве лигандов. Например:
Сульфиды Zn, Cd, Hg – осадки с различной растворимостью: Zn2+ + S2– = ZnS$ Cd2+ + S2– =CdS$ Hg2+ + S2– = HgS$ белый желтый черный ПР=8×10–26 ПР=1×10–29 ПР=1×10–58
Растворение сульфидов ZnS + 2HCl(разб.) = ZnCl2 + H2S CdS и HgS - в разбавленных HCl и H2SO4 не растворяются CdS + 4HCl(конц) = H2[CdCl |

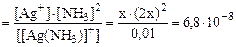 ;
; 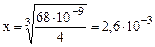 моль/л.
моль/л.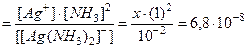 , x = 6,8×10–10 моль/л.
, x = 6,8×10–10 моль/л.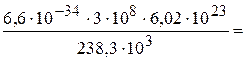
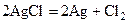 ;
;
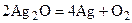 .
.
 H2O не реагируют
H2O не реагируют HCl не реагируют
HCl не реагируют Cu H2SO4(разб) не реагируют
Cu H2SO4(разб) не реагируют Ag H2SO4(конц.) SO2 + ЭхSO4
Ag H2SO4(конц.) SO2 + ЭхSO4 HNO3 (разб.) NO + Э(NO3)x
HNO3 (разб.) NO + Э(NO3)x
 HNO3 (конц.) NO2 + Э(NO3)x
HNO3 (конц.) NO2 + Э(NO3)x
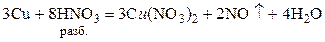
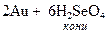

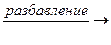 Cu(OH)2↓ + 2NaOH
Cu(OH)2↓ + 2NaOH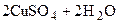 D
D 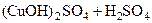
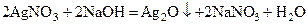
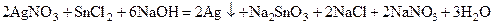
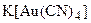 , роданидных
, роданидных 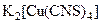 , тиосульфатных
, тиосульфатных 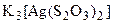 и других ацидокомплексов. Склонность к комлексообразованию усиливается в ряду Cu
и других ацидокомплексов. Склонность к комлексообразованию усиливается в ряду Cu 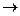 Ag
Ag 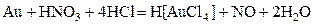
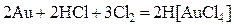
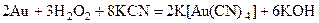
 Запишем полуреакции, просуммируем их, допишем недостающие ионы и составим окончательное уравнение:
Запишем полуреакции, просуммируем их, допишем недостающие ионы и составим окончательное уравнение: 2
2  Au + 4I– 3е = [AuI4] –
Au + 4I– 3е = [AuI4] – 2 K+ 2 K+
2 K+ 2 K+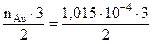 = 1,52·10 -4 молей, что составляет
= 1,52·10 -4 молей, что составляет

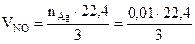 = 0,075 л
= 0,075 л D
D 
 .
.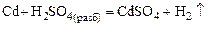
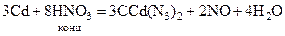 .
. (при избытке кислоты), так и закисной ртути
(при избытке кислоты), так и закисной ртути 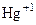 (при избытке ртути), например:
(при избытке ртути), например: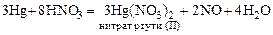 .
. .
. D
D 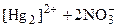 .
.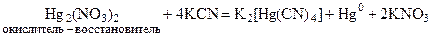

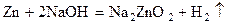
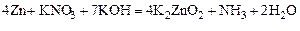
 D
D 
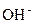 , а ион кислорода:
, а ион кислорода: D
D  .
.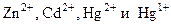 характерна склонность к комплексообразованию. Большинство нерастворимых в воде соединений цинка и кадмия растворяется в аммиачном растворе. Например:
характерна склонность к комплексообразованию. Большинство нерастворимых в воде соединений цинка и кадмия растворяется в аммиачном растворе. Например: