
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Образцы решений задач и упражненийСодержание книги
Поиск на нашем сайте
Пример 1. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Si → Na2SiO3 → H4SiO4 → SiO2 → SiCl4 → K2SiO3; Решение. 1. При сплавлении кремния с щелочью получают силикат натрия: Si + 2NaOH + H2O = Na2SiO3 + 2H2↑ 2. При действии разбавленной соляной кислоты на силикат натрия получают гель кремневой кислоты: Na2SiO3 + HCl(разбавл.) = SiO2·2H2O + 2NaCl (H4SiO4)
3. При нагревании кремневой кислоты получают оксид кремния (SiO2): H4SiO4 (tº) = SiO2 +2H2O 4. Для получения тетрахлорида кремния из SiО2, его восстанавливают магнием и затем хлорируют: SiО2 + 2Мg (tº) = 2МgО + Si Si + 4HClгаз 5. При гидролизе SiСl4 можно получить SiО2, который сплавляют с КОН: SiCl4 + 2H2O(tº) = SiО2 + 4HCl; SiО2 + 2KOH = K2SiO3 + H2O Пример 2. Смесь оксида углерода(IV) и азота занимает при нормальных условиях объем 4.032 л. Массовые доли газов в ней равны. Какая соль образуется при пропускании этой смеси объемом 2 л через раствор массой 20 г с массовой долей гидроксида натрия 28%? Решение. Определяем общее количество вещества газовой смеси: n(смеси) Вычисляем массу и количество вещества оксида углерода (IV) в смеси, приняв, что масса смеси равна m, и учитывая, что ω(CO2) = ω(N2) = 0,5: m(CO2) = ω(CO2)·m = 0,5·m; Аналогично получаем: m(N2) = ω(N2)·m = 0,5 m; m(N2) = 0,5 m; n(N2) Так как n(смеси) = n(N2) + n(CO2), получаем
Отсюда находим массу смеси газов: m = 6,16 г. При пропускании смеси через раствор гидроксида натрия возможна одна из реакций: если CO2 в недостатке – СО2 + 2NaОН = Na2CO3 + H2O (а) если CO2 в избытке – СО2 + NаОН = NаНСО3 (б) Определяем количество вещества CO2. содержащегося в смеси:
Рссчитываем массу и количество вещества NаОН в растворе: m(NaOH) = m(смеси) ·ω(NaOH) =20·0,28 = 5,6 г; n(NaOH) Получаем
что соответствует уравнению реакции (а), следовательно, будет образовываться средняя соль – карбонат натрия.
Образцы тестового опроса Si, Ge
1. Укажите электронную формулу атома кремния: 1) 1s22s22p63s23p4 2) 1s22s22p63s23p2 3) 1s22s22p63s03p0 4) 1s22s22p63s23p6 5) 1s22s22p63s23p0 2. Укажите характер оксида кремния (II): 1) основной 2) кислотный 3) безразличный 4) амфотерный 3. Укажите продукты реакции травления кремния раствором гидроксида калия: 1) K2SiO3 + H2 3) H2SiO3 + K 2) SiO2 + K2O + H2O 4) K2SiO3 + H2O 4. Укажите продукты полного гидролиза хлорида кремния (IV): 1) SiOCl + HCl 3) H2SiO3 + HCl 2) SiO2 + Cl2 4) SiO2 + HCl
5. Укажите, к какому классу неорганических соединений относится H2[GeF6]: 1) солей 2) оснований 3) кислот 4) оксидов 5) гидроксидов
Sn, Pb 1.Укажите количество электронов на 6-м уровне атома свинца 1) 6; 2) 4; 3) 2; 4) 3; 5) 5. 2. Укажите вещество, образующееся при действии избытка азотной кислоты на станнит натрия 1) Sn(NO3)4; 2) Na2SnO2; 3) Sn(NO3)2; 4) Na2SnO3; 5) Sn(OH)2. 3. Укажите валентность свинца в соединении Pb2PbО4 1) 2 и 3; 2) 4 и 1; 3) 1 и 2; 4) 2; 5) 2 и 4. 4. Укажите продукты взаимодействия олова с конц. серной кислотой 1) Sn(SO4)2 + SO2 + H2O; 2) Sn(SO4)2 + H2S + H2O; 3) SnSO4 + S + H2O; 4) Sn(OH)2 + SO2 + H2O; 5) Sn(OH)4 + H2S + H2O. 5. Укажите продукты реакции SnCl2 + HNO3 + HCl ® 1) SnCl4 + N2O + H2O; 2) SnCl4 + NO + H2O; 3) Sn(NO3)2 + NO + H2O; 4) Sn(OH)4 + NO2 + H2O; 5) Sn(OH)2 + N2O + H2O;
Контрольные вопросы и упражнения 1. Охарактеризуйте электронное строение атомов и возможные валентные состояния р-элементов IV группы. Какие степени окисления проявляют указанные элементы в соединениях? 2. Охарактеризуйте изменение атомных радиусов, энергии ионизации, сродства к электрону и электроотрицательности в ряду С -Pb. 3. Охарактеризуйте изменение устойчивость соединений указанных элементов в их высшей степени окисления в ряду C – Pb. 4. Охарактеризуйте изменение окислительно-восстановительных свойств простых веществ при переходе от углерода к свинцу, их отношение к воде, кислотам, щелочам, солям. Напишите уравнения соответствующих реакций. 11. Охарактеризуйте зависимость кислотно-основных свойств оксидов и гидроксидов р-элементов IV группы от степени их окисления. Как изменяются кислотно-основные свойства однотипных оксидов и гидроксидов в ряду углерод – свинец? Приведите уравнения соответствующих реакций. 12. Объясните различия в строении и в химических свойствах галогенидов p-элементов IV группы. К каким классам соединений относятся GeCl4, SnCl4; SnCl2,PbCl2? Напишите уравнения реакций гидролиза SiCl4 и SiF4. 13. Укажите степень окисления свинца в оксидах РbО, РbО2, Pb3O4. Как эти соединения взаимодействуют с разбавленными и концентрированными растворами НС1, Н2SO4? 14. Укажите, какие из соединений p-элементов IV группы используются в лабораторной практике а) в качестве типичных окислителей; б) в качестве восстановителей. Приведите примеры реакций c их участием. 15. Укажите, какие из указанных солей гидролизуются сильнее:
а) Sn(NO3)2 или Pb(NO3)2; б) Na2CO3 или Na2SiO3. Почему? 17. Укажите, почему в водных растворах невозможно синтезировать карбонаты железа (III), хрома(Ш), алюминия. Какие вещества могут получиться при смешивании растворов Рb(NO3)2 и Na2CO3? 18. Что представляет собой активированный уголь? Где он используется? Чем объясняется его высокая сорбирующая способность? 19. Смесь кремния с оксидом кремния (IV) обработали избытком раствора гидроксида натрия, в результате чего выделился газ объемом 6,72 л (н.у.). Из образовавшегося раствора был выделен метасиликат натрия массой 25 г. Вычислить значение массовой доли кремния в исходной смеси. Ответ: 56 %. 20. Смесь углерода со свинцом обработали при нагревании избытком концентрированного раствора азотной кислоты, в результате чего выделилась смесь газов объемом 15,68 л (н.у.). При пропускании этой смеси через избыток известковой воды образовался осадок массой 10 г. Вычислить значение массовой доли углерода в исходной смеси. Ответ:18,9 % 22. Закончите уравнения следующих реакций (кислота и щелочь берутся с некоторым избытком): а) Sn(NO3)2 + KOH → б) Pb(CH3COO)2 + KOH → в) Na2[Sn(OH)6] + HCl→ г) Na2PbO2 + HNO3 → 23. Напишите уравнения реакций, при помощи которых можно осу- а) СО2 → СОС12 → СO2 → С → А14С3 →CH4; б) Si → Na2SiO3 → H4SiO4 → SiO2 → SiCl4 → K2SiO3; в) CO2 → NH4HCO3 → BaCO3 → CO2 → CO → COBr2; г) Рb → Рb(ОН)2 → РbO2 → Рb3O4 → РbС12 → Н2[РbС16]. 24. Укажите, у каких оксидов преобладают кислотные свойства: PbO или SnO; б) PbO или PbO2, в) SnO2 или GeO2. Ответ обоснуйте. 25. Напишите схемы равновесия в насыщенных растворах амфотерных гидроксидов: а) свинца (II); б) олова (IV). 26. Напишите уравнения реакций получения станнита и станната калия из сульфата олова (II). В чем принципиальное различие обоих процессов? 27. Изобразите графически распределение химических связей в молекулах Pb2O3 и Pb3O4. Какие окислительные числа имеет свинец в этих соединениях? Солями каких кислот можно считать эти соединения? 28. Закончите уравнения следующих реакций: 1) NaOH + H2O + Si (C, Sn, Pb) → 2) NaOH + H2O2 + Ge → 3) H2SO4 (конц.) + Sn (C, Si, Pb) → 4) HNO3 (конц.) + Sn (C, Si, Pb) → 5) Mg2Si + H2SO4 (разбавл.)→ 6) MnSO4 + PbO2 + H2SO4 → 7) Sn + KOH + H2O → 8) SiO2 + HF → 9) SnCl2 + NaBiO3 + HCl → H2 [SnCl6] +... 10) GeCl2 + O2 + NaOH + H2O → 11) Pb + KOH + H2O → 12) PbS + H2O2 → 29. Газ, который получили действием избытка раствора соляной кислоты на карбонат кальция массой 40 г, поглотили раствором гидроксида натрия. В результате образовался карбонат натрия. Вычислите объем раствора с массовой долей гидроксида натрия 20% и плотностью 1,22 г/мл, который израсходовали на поглощение образовавшегося газа. Ответ:131.15 мл. 30. Какую массу кремния и какой объем гидроксида натрия с массовой долей 32% и плотностью 1,35 г/мл потребуется для получения 15 м3 водорода (17 ºС, 98,6 кПа)? Ответ:8,6 кг; 56,7 л. 31. Какую массу свинца можно получить, проводя электролиз водного раствора нитрата свинца (II) массой 60 г? Массовая доля соли в растворе равна 15%. Какой объем газа, измеренный при нормальных условиях, выделится при электролизе? Ответ: 5,63 г; 3,05 л.
Элементы III-A подгруппы B, Al, Ga, In, Tl Атомы элементов имеют электронную конфигурацию валентных уровней ns2p1 и проявляют степени окисления +3 (B Al Ga In), +1 (Tl) Физические свойства
Бор Бор – неметалл, полупроводник. Ион B+3 обладает малым радиусом при большом заряде, он образует только ковалентные связи, образует только анионы, B(OH)3 - проявляет слабокислотные свойства - кислота (H3BO3 борная кислота). Минералы: H3BO3 – борная кислота, Na2B4O7∙10H2O - бура MgHBO3 - ашарит Mg7Cl2B16O30 - борацит
Получение бора. Приведены схемы получения бора из буры и оксида бора: Na2B4O7
B2O3 + 3Mg = 3MgO + 2B продукты обрабатывают HCl, для растворения MgO. Для получения бора высокой чистоты проводят его дополнительную очистку по схеме (1) или (2): 1) B
2) 2BBr3 + 3H2
Бор осаждают на поверхности металла (Ta, Mo или W при t°) Твердость кристаллического бора 9. Бор – полупроводник, при нагревании до 600°С его электропроводность повышается ~ в 100 раз. Чистый бор можно получать пиролизом: B2H6 Химические свойства бора При комнатной t° инертен, подобен Si.
B
1) При t° красного каления (~ 700°C) 2B + 6H2O (пары) = 2H3BO3 + 3H2 2) Из кислот взаимодействует с конц. HNO3, H2SO4, царской водкой: B + 3HNO3 = H3BO3 + 3NO2 2B + 3H2SO4 = B2O3 + 3SO2 + 3H2O
Водородные соединения (бораны) образуют два гомологических ряда: 1) BnHn+4, B2H6 - диборан 2) BnHn+6, B4H10 - тетраборан Получают действием разбавленной соляной кислоты на бориды металлов, например, на Mg3B2: 2Mg3B2 + 12HCl = H2 + B4H10 + 6MgCl2 При этом наряду с тетрабораном B4H10, выделяется смесь боранов: B4H10, B5H9, B6H10, B10H14 и др. Разделить их можно фракционной перегонкой в вакууме. Диборан - газ, остальные жидкости, бесцветные, с отвратительным запахом, ядовиты, разлагаются водой: B2H6 + 6H2O = 2H3BO3 + 6H2 Бораны являются реакционно-способными соединениями. Горят с выделением большого количества тепла (при сгорании 1 моля В2Н6 -выделяется 2028 КДж), используют в качестве эффективного ракетного топлива. Применяют в синтезах неорганических полимеров. Кислородные соединении. B2O3 - борный ангидрид, бесцветная стекловидная масса, на воздухе поглощает воду и в ней растворяется: B2O3 + 3H2O = 2H3BO3 ортоборная кислота Получают оксид бора при взаимодействии бора с кислородом или при разложении борной кислоты: 4В + 3О2 2Н3ВО3
Н3ВО3 - ортоборная кислота, бесцветные кристаллы, мало растворимы в воде. В 0,1 н растворе степень диссоциации α ~ 0,01 %. При нагревании возможны переходы: H3BO3 метаборная тетраборная
Соли (бораты) являются производными от различных полиборных кислот xB2O3∙yH2O, наиболее часто встречаются соли тетраборной кислоты H2B4O7: (x = 2, y = 1). Например: Na2B4O7∙10Н2О – бура. Ее применяют: – при пайке и сварке металлов(расплавленная бура растворяет оксиды металлов), – в производстве специальных стекол, эмалей, – в аналитической химии. Гидролиз буры: Na2B4O7 + 7H2O = 2NaOH + 4H3BO3 Карбид бора B4С получают сплавлением в электрических печах: 2В2О3 + 4С = В4С + 3СО2 В4С - самый твердый из известных соединений, царапает алмаз, Тплавл. = 2350°С, применяют в качестве абразивного материала и в ядерной технике. Нитрид бора ВN - получают при прокаливании: B3O3 + 2NH3 = 2BN + 3H2O BN -похож на тальк, Тплавл. =3000°С, имеет структуру графита, на него не действуют любые кислоты и щелочи. Используют в качестве изолятора при высоких температурах.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 438; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.27.70 (0.009 с.) |

 SiCl4 + 2H2
SiCl4 + 2H2 моль.
моль.


 моль.
моль.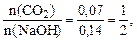
 H3BO3
H3BO3  B2O3
B2O3  B
B BBr3
BBr3  +H2
+H2  B
B 2B + 6HBr
2B + 6HBr 2B + 3H2
2B + 3H2
 В2О3
В2О3 Mg3B2
Mg3B2 ВГ3
ВГ3 В2S3
В2S3 В4С
В4С ВN
ВN не идет
не идет 2В2О3
2В2О3


