
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Использование бора в технике
1. Бор - полупроводник 2. Добавка в сталь - повышает механические свойства 3. В ядерной технике (В10 - поглощает нейтроны), В4С - для изготовления регулирующих стержней атомных реакторов 4. В ядерных счетчиках для регистрации нейтронов.
Алюминий. Промышленные руды: боксит - AlO(OH) криолит - Na3[AlF6] каолин - Al2O3×2SiO2×2H2O нефелин - Na2O×Al2O3×2SiO2 (Корунд, рубин, сапфир - Al2O3, хризоберил - BeAl2O4) Получение. Ниже приведена схема получения алюминия из боксита с последующим электролизом расплава Al2O3: 1) AlO(OH) →Al(OH)3 → Al2O3 2) электролиз расплава Al2O3 (tº = 2050ºС) в присутствии добавок CaF2, MgF2 или AlF3 для повышения электропроводности и снижения tºпл до 950º С): (–) Kатод: 4Al3+ + 12ē = 4Alº (+) Aнод: 6O2– – 12ē = 3O2↑ Физические свойства Серебристо-белый металл, плотность 2,7 г/см3, tпл =660ºС, tкип =2348ºС. На воздухе покрывается защитной оксидной пленкой. Обладает большой тягучестью и высокой электропроводностью (~0,6 от электропроводности Cu, но в 63 раза легче меди) Химические свойства. Алюминий – активный металл и взаимодействует практически со всеми простыми веществами (при нагревании), кроме водорода:
+ O2 ¾→ Al2O3 + S ¾→ Al2S3 Al + Cl2 ¾→ AlCl3 + N2 ¾→ AlN, + C ¾→ Al4C3 + P ¾→ AlP 2) Взаимодействие с кислотами и щелочами
Al + HCl, H2SO4(ср.конц.)¾→Al3+, H2 + H2SO4(конц. to) ¾→Al3+,(SO2, S, H2S) + HNO3(ср.конц.) ¾→Al3+, NH4NO3
Без защитной пленки реагирует с водой: 2Al + 6H2O = 2Al(OH)3 + 3H2↑ Кислоты: Сильно разбавленные, а также концентрированные HNO3 и H2SO4 на Al не действуют. Под воздействием концентрированных – он пассивируется (образуется защитная пленка толщиной ~20-30 мкм.). Пассивированный Al без нагревания не растворяется ни в каких кислотах. С уксусной и фосфорной кислотами - не взаимодействует. Чистый Al довольно устойчив по отношению к HCl Кислородные соединения Al2O3 и Al(OH)3 - амфотерны Al3+ + 3OH–DAl(OH)3DH3AlO3–H2O→HAlO2DH+ + AlO2– 1) Al(OH)3 + 3HCl = AlCl3 + 3H2O 2) Al(OH)3 + NaOH = Na[Al(OH)4] - тетрагидроксоалюминат(III) натрия
Соли Al подвергаются гидролизу. Al2S3, Al2(CO3)3 - в водных растворах не существуют, т.к. происходит полный гидролиз. 2AlCl3 + 3Na2CO3 +6H2O = 2Al(OH)3$+ 3Н2О + 3СО2+ 6NaCl Применение алюминия – Алюминотермия (метод восстановления металлов из их оксидов)
– Сварка: 8Al + 3Fe3O4 = 4Al2O3 + 9Fe – Получение тугоплавких металлов (Cr, V, Mn): Cr2O3 + 2Al = Al2O3 + 2Cr – Искусственный рубин: Al2O3 + Cr. Лазеры. – Аммонал (в.в.) - тончайший порошок Al в смеси с окислителями (NH4NO3) – От предметов быта до ракетостроения.
Галлий, индий, таллий В земной коре содержание этих металлов невелико: Ga – 4∙10–4 %, In – 2∙10–6 %, Tl 8∙10–7 %. Собственных минералов не имеют, сопутствуют другим элементам: а) в германите - 0,6 - 0,7 % Ga, б) в ZnS - встречается In, в) Tl - спутник сульфидных руд Fe, Zn, Cu. Получение. Технология получения чистых металлов – дорогостоящий процесс и включает: 1. Отделение от основных металлов 2.Концентрирование 3. Электролитическое получение 4. Очистка (зонная плавка или электролитическое рафинирование). Физические свойства Мягкие (режутся ножом), пластичные, легкоплавкие серебристо-белые металлы. Индий - равномерно отражает световые волны всех длин, применяют для изготовления зеркал в оптике. Галлий - в расплавленном состоянии может сохранять в течение долгих месяцев жидкое состояние. Применяют для изготовления кварцевых термометров для высоких температур (600 - 1500°С). Химические свойства. При нагревании реагируют почти со всеми простыми веществами (кроме водорода):
Ga In
Tl1+ - похож на щелочные металлы, Tl3+- на алюминий. Tl -тускнеет на воздухе ®Tl2O +Tl2O3 4Tl + O2 =2Tl2O 2Tl + 3H2O2 = Tl2O3 + 3H2O Взаимодействие с кислотами Галлий и индий с разбавленными кислотами (HCl, H2SO4, HNO3) образуют соли трехвалентных элементов (как Al). Таллий растворяется лишь в кислотах - окислителях или кислотах, насыщенных кислородом. При этом образуются осадки: TlCl, Tl2SO4 Щелочи очень медленно растворяют Ga и In: 2Ga + 6NaOH + 6H2O = 3H2 + 2Na3 [Ga(OH)6] гексагидроксогаллат(III) натрия Na3[In(OH)6] - гексогидроксоиндат(III) натрия Соединения таллия амфотерными свойствами не обладают и таллий со щелочами не взаимодействует.
|
||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 259; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.184.214 (0.007 с.) |

 + NaOH ¾→ Na[Al(OH)4] + H2
+ NaOH ¾→ Na[Al(OH)4] + H2

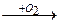 Э2О3
Э2О3  Tl2O
Tl2O ЭГ3 Tl
ЭГ3 Tl 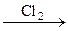 TlCl
TlCl Э2S3
Э2S3  Tl2S
Tl2S
 интерметаллические соединения (со Pb, Sn, Al, Zn)
интерметаллические соединения (со Pb, Sn, Al, Zn) ≠ не идет
≠ не идет


