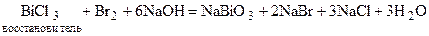Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термическое разложение нитратов
ôMe до Mg──→ Me(NO2) + O2 Me(NO3)2 ô(Mg – Cu) ──→MeyOx + NO2 + O2 ôпосле Cu ──→ Me + NO2 + O2
Примеры: KNO3 (tº) = KNO2 + O2 Zn(NO3)2 (tº) = ZnO + NO2 + O2 AgNO3 (tº) = Ag + NO2 + O2 Азотистая кислота и нитриты Азотистая кислота слабая и неустойчивая. Соли – нитриты обладают окислительно-восстановительной двойственностью:
Фосфор Фосфор в свободном состоянии существует в виде нескольких аллотропических модификаций (белый, красный, черный). Он легко соединяется с кислородом (белый воспламеняется), галогенами, серой, металлами. С водородом фосфор непосредственно не соединяется. Соответствующее водородное соединение фосфин получается косвенным путем из фосфидов: Mg3P2 + 6HCl = 3MgCl2 + 2PH3 Фосфор окисляется концентрированной азотной кислотой до ортофосфорной кислоты:
При действии щелочи он диспропорционирует с образованием фосфина и гипофосфита: 4P + 3NaOH + 3H2O = PH3 + 3NaH2PO2 С водородом фосфор образуют летучие соединения ЭH3. NH3 (аммиак) и PH3 (фосфин) существенно различаются по свойствам. Молекулы NH3 полярны, а PH3 – неполярны. В соответствии с этим, аммиак взаимодействует в водой с образованием слабого основания, диссоциирующего далее на ионы аммония и гидроксид-ионы:
Фосфин – ядовитый газ, слабо растворим в воде, не взаимодействует с нею, а аналогичный ион фосфония PH4+ образуется лишь при взаимодействии PH3 с очень сильными кислотами HClO4 и HI: РH3+ HI = PH4I. Фосфор образует с кислородом оксиды P2O3 и P2O5. Оксиду P2O3 соответствует двухосновная фосфористая кислота H2HPO3 (H3PO3), в которой на металл могут заместиться лишь два атома водорода. Оксид фосфора P2O5 образует большое количество кислот, из которых наиболее важны метафосфорная (HPO3), ортофосфорная (H3PO4) и пирофосфорная (H4P2O7). Ортофосфорная кислота образует средние соли – фосфаты и кислые – гидро- и дигидро-фосфаты, например Na3PO4, Na2HPO4, и NaH2PO4. Растворимы в воде фосфаты только щелочных металлов. Их водные растворы имеют щелочную реакцию среды за счет гидролиза: PO43- + H2O Na3PO4 + H2O Фосфорная кислота является кислотой средней силы и не обладает ярко выраженными окислительными свойствами. Она используется в составе травителей как регулятор скорости, обеспечивая оптимальную вязкость травителей.
Фосфорноватистая кислота (НH2PO2) – одноосновная, ее кислотные свойства выражены несколько сильнее, чем у двухосновной фосфористой. H2НPO3 и ее соли (гипофосфиты) обладают также несколько более сильными восстановительными свойствами (особенно в кислой среде), чем фосфористая кислота и фосфиты. Мышьяк. Сурьма. Висмут. Мышьяк As, сурьма Sb, висмут Bi являются полными электронными аналогами азота и фосфора. Это р‑элементы, их атомы имеют степени окисления: ‑3, +3 и +5. В подгруппе от As к Bi электроотрицательность резко уменьшается, металлические свойства усиливаются. В соответствии с этим устойчивость соединений в различных степенях окисления различна: если для мышьяка наиболее устойчиво состояние +5, то для висмута +3. В свободном состоянии эти элементы являются слабыми восстановителями. Их стандартные электродные потенциалы положительны, в связи с чем вода и разбавленные кислоты (HCl и H2SO4) при комнатной температуре на них не действуют. Растворы азотной и концентрированная серная кислота окисляют эти элементы с образованием различных продуктов:
С галогенами и кислородом As, Sb и Bi реагируют довольно энергично с образованием соединений типа ЭГ3 и ЭГ5 (например, AsCl3 и AsCl5). Водородные соединения получают косвенным путем: Mg3As2 + 6HCl = 3MgCl2 + 2AsH3 Соединения мышьяка и сурьмы с металлами (арсениды, антимониды) и водородом (арсин, стибин, висмутин) являются сильными восстановителями: 5AsH3 + 8KMnO4 + 12H2SO4 = 5H3AsO4 + 8MnSO4 + 4 K2SO4 + 12H2O В ряду AsH3, SbH3, BiH3 устойчивость соединений уменьшается, а восстановительная способность возрастает. Висмутин очень нестоек и разлагается уже при комнатной температуре. В степенях окисления +3 и +5 As, Sb, и Bi образуют соединения с более электроотрицательными элементами (кислородом, серой, галогенами). Соединения As, Sb, и Bi в степени окисления +3 обладают окислительно-восстановительной двойственностью. Например:
В ряду As+3, Sb+3, Bi+3 восстановительные свойства ослабевают. Оксиды и гидроксиды мышьяка, сурьмы и висмута (V) обладают кислотными свойствами. Мышьяковая (H3AsO4) и сурьмяная (HSbO3) кислоты являются слабыми кислотами, их соли (арсенаты и антимонаты) проявляют окислительные свойства только в кислой среде:
K3AsO4 + 2KI + H2SO4 = K3AsO3 + I2 + K2SO4 + H2O Из кислородных соединений висмута (V) наиболее характерны соли висмутаты, являющиеся сильными окислителями, как в кислой, так и в щелочной средах: 5KBiO3 + 2Mn(NO3)2 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 5KNO3 + 7H2O NaBiO3 + 5FeSO4 + 9NaOH + 3H2O = Bi + 5Fe(OH)3 + 5Na2SO4
|
||||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 405; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.15.15 (0.006 с.) |

 .
.
 NH4OH
NH4OH