
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Подгруппа селена: Se, Te, PoСтр 1 из 9Следующая ⇒
Получают из отходов сернокислотного производства. Химические свойства 1. Se, Te -похожи на S; 2. Se, Te + F2, Cl2 (с O2 только при нагревании); 3. Se + H2 = H2Se Te +H2 ≠ не идет 4. Se, Te +Me → K2Se K2Te 5. K2Se + 2HCl = 2KCl + H2Se K2Te + 2HCl = 2KCl + H2Te В ряду H2S H2Se H2Te ¾¾¾¾¾¾¾¾¾→ усиление кислотных и восстановительных свойств Кислородные соединения: ЭО2 и ЭО3 Получение оксидов ЭО2: Se + O2 2H2Se + 3O2 = 2SeO2 + 2H2O 2H2Te + 3O2 = 2TeO2 + 2H2O Оксидам ЭО2 соответствуют кислоты Н2ЭО3; Получение кислот: 1) SeO2 + H2O = H2SeO3 TeO2 + H2O ≠ селенистая кислота теллуристая кислота не получена 2) 3Se + 4HNO3 + H2O = 3H2SeO3 + 4NO Cоли: H2SeO3+2NaOH=Na2SeO3+2H2O TeO2+2NaOH = Na2TeO3+H2O селенит натрия теллурит натрия
У селенитов (Se+4) и теллуритов (Te+4) преобладают окислительные свойства, в отличие от сульфитов (S+4), у которых преобладают восстановительные свойства. Sº Se0, Te0
Примеры. а). Селенит (Se+4) - окислитель: H2SeO3 + 4HI = Se + 2I2 + 3H2O (слабая кислота) б) Селенит (Se+4) - восстановитель (малохарактерно) 3H2SeO3 + HClO3 = 3H2SeO4 + HCl Оксиды ЭО3 получают из кислот: H2TeO4 TeO3 – порошок желтого цвета, не растворяется в воде и кислотах. Кислоты: H2SeO4 по силе подобна серной (H2SO4), сильный окислитель ее соли - селенаты также окислители. H2TeO4 - теллуровая к-та, это слабый электролит, ее соли – теллураты.
TeO3 + NaOH теллурат Na
Селеновая кислота (концентрированная) растворяет золото: 6H2SeO4 + 2Au (t°) =Au2(SeO4)3 + 3SeO2 + 6H2O концентр. Получение кислот H2ЭО4: Ag2SeO3 + Br2 + H2O = H2SeO4 + 2AgBr↓ Te +H2O2 = H2TeO4∙2H2O (TeO3∙3H2O ≡ H6TeO6 ортотеллуровая кислота H6TeO6 Образцы решения задач Пример 1. Из значения произведения растворимости осадка ZnS (ПP= 2,5·10–22) вычислите концентрацию ионов цинка в моль/л и г/л. Решение. Растворенная часть осадка диссоциирует: ZnS D Zn2+ + S2– Произведение растворимости – произведение концентраций ионов над осадком: ПРZnS = [Zn2+][S2–] Обозначим концентрацию ионов цинка и равную ей концентрацию сульфид-иона – x, тогда: ПРZnS = [x][x]= x2 отсюда х = [Zn2+] = [Zn2+] = 1,6·10–11·65,4= 1·10–9 г/л, (65,4 – молярная масса иона цинка).
Пример 2. К раствору, содержащему в 1 л 10–6 М Pb(NO3)2 прибавили 1л 1·10–18 M раствора Na2S. Выпадет ли осадок? (ПPPbS = 2,5·10–27). Решение. Осадок выпадает при условии, когда произведение концентраций ионов больше значения ПР: [Pb2+][S2–] > ПР
При сливании 2-х л растворов концентрация ионов [Pb2+] и [S2–] уменьшится в 2 раза и составит: [Pb2+] = 5 ·10 –6 моль/л; [S2–] = 5·10–19 моль/л. [Pb2+][S2–] = 5 ·10 –6·5 ·10 –19 = 2,5 ·10 –24. Эта величина больше значения ПР: 2,5 ·10 –24> 2,5·10–27, осадок выпадет.
Пример 3. Вычислить произведение растворимости сульфида кадмия (II), если его растворимость при комнатной температуре равна 1, 3·10–4 г в 100 г воды. Решение. Диссоциация растворенной части осадка идет по уравнению: CdS D Cd2+ + S2– Концентрацию [CdS] и равную ей концентрацию ионов [Cd2+] и [S2–] выразим в моль/л (приняв плотность такого разбавленного раствора за 1): См = ПР CdS = [Cd2+]·[S2–]; ПР CdS = [9·10–6]·[9·10–6] = 8,1·10–11.
Пример 4. Какой объем концентрированной серной кислоты плотностью 1,84 г/мл, в которой массовая доля кислоты составляет 98%, необходимо взять для полного растворения меди массой 8 г? Какой объем оксида серы (IV), измеренный при нормальных условиях, выделится при этом? Решение. Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O Количество вещества меди рассчитываем по формуле:
Масса серной кислоты: Масса 98%-ной серной кислоты:
Пример 5. Какой объем оксида серы (IV), измеренный при температуре 27 ºС и давлении 98,5 кПа, образуется при обжиге пирита массой 30 г, который кроме дисульфида железа FeS2 содержит примеси, не образующие при обжиге SО2? Массовая доля примесей в пирите составляет 20%. Решение. Записываем уравнение реакции обжига дисульфида железа: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 Массовая доля примесей в пирите составляет 20%, следовательно, массовая доля FeS2 составляет 80%, или 0,8. Определяем массу дисульфида железа в пирите: m(FeS2) = m(пирита)·ω (FeS2); m(FeS2) = 30·0,8 = 24 г. Определяем количество вещества дисульфида железа: n(FeS2) = Из уравнения реакции следует: Отсюда получаем: n(SO2) = 2n(FeS2) = 2·0,2 = 0,4. Вычисляем объем образовавшегося оксида серы (SO2) при нормальных условиях: V0(SO2) = n(SO2)·22,4 = 0,4·22,4 = 8,96 л. Находим объем газа при указанных условиях, учитывая, что Т = 273+27 = 300К:
Образец тестового опроса S, Se, Te, Po
1. Укажите электронную формулу серы в степени окисления +4: 1) 1s22s22p63s23p64s23d104p34d1 2)...............................4s23d154p64d5 3)..............................4s23d104p6 4)...............................4s23d104p0 5).............................. 4s03d10 2. Укажите продукты, образующиеся при обработке смеси порошков меди и цинка разбавленной H2SO4: 1) CuSO4 + ZnSO4 + H2 2) ZnSO4 + H2 3) CuSO4 + SO2 4) ZnSO4 + H2S 5) CuSO4 + SO2 + ZnSO4 3. Укажите продукты совместного гидролиза сульфата алюминия и сульфида натрия: 1) Al(OH)3 + H2S + Na2SO4 2) AlOHSO4 + NaHSO4 3) Al2S3 + Na2SO4 4) Al(HSO4)3 + Na2SO4 5) Al(OH)3 + NaHS 4. Укажите продукты взаимодействия селенистой кислоты с перoксидом водорода: 1) H2SeO4 + H2O 2) SeO2 + O2 3) H2SeO3 + O2 4) SeO2 + H2O 5) SeO3 + O2 5. Укажите, растворы каких солей имеют щелочную реакцию среды: 1) Na2SO3 2) K2SO4 3) (NH4)2SO4 4) К2S 5) ZnSO4 Контрольные вопросы и упражнения 1. Охарактеризуйте строение атомов и валентные состояния элементов главной подгруппы VI группы. 2. Как изменяются радиусы, ионизационные потенциалы, сродство к электрону и электроотрицательность в ряду кислород - полоний? 3. Как и почему изменяется агрегатное состояние и состав простых веществ в ряду О - Ро? 4. Проиллюстрируйте соответствующими реакциями характер изменения окислительно-восстановительных свойств в ряду кислород - полоний 5*. Объясните способность серы и ее аналогов проявлять степени окисления +4 и +6. Почему валентное состояние VI более характерно для серы, чем для селена и теллура? 6. Дайте сравнительную характеристику изменения кислотно-основных и окислительно-восстановительных свойств водородных соединений элементов VIА подгруппы. 7. Как доказать, что сероводород обладает бо́льшей восстановительной способностью по сравнению с оксидом серы(IV)? Напишите уравнения соответствующих реакций. 8*. Какой продукт получится, если через разбавленный раствор аммиака длительное время пропускать сильную струю сероводорода? Изменится ли состав продукта, если затем к раствору прилить концентрированный раствор аммиака? 9. Составьте уравнения реакций гидролиза сульфидов CaS и SiS2. Отличается ли характер гидролиза этих веществ под влиянием воды и водяных паров? 10*. Какие из сульфидов – Al2S3, Cr2S3, Na2S, ZnS, PbS, La2S3 – могут гидролизоваться? Какие из названных сульфидов могут быть получены путем обменной реакции в водном растворе? Напишите уравнения реакций гидролиза. Объясните, почему некоторые из перечисленных сульфидов не гидролизуются. Предложите методику синтеза всех указанных сульфидов, учитывая отношение их к воде. 11. Какую реакцию среды имеют растворы N2SО3 и NаНSО3? Вычислите Кг для сульфит- и гидросульфит-ионов, пользуясь значением констант диссоциации сернистой кислоты. 12. Укажите способы получения оксидов серы. Как изменяются окислительно-восстановительные свойства у этих соединений? Напишите уравнения соответствующих реакций. 13. Каким способом можно получить соединение серы с кислородом, в котором сера проявляет наименьшую возможную для нее положительную степень окисления? 14. Сернистая кислота и ее соли. Строение, окислительно-восстановительные свойства, применение. Напишите уравнения соответствующих реакций. 15. Как изменяется устойчивость, кислотные свойства и окислительно-восстановительная способность в ряду Н2SО3 - Н2ТеО3? 16.* Cульфит натрия сплавили с углем. Какой продукт получился при этом? Напишите уравнение соответствующей реакции.
17*. Опишите методику приготовления сульфита и гидросульфита калия. 18*. Какие два важных продукта образуются при пропускании SO2, водяного пара и кислорода через нагретый раствор поваренной соли? Составьте уравнения реакций. 19. Какой продукт получится, если смесь раствора сульфита натрия и серы прокипятить? 20*. Напишите уравнение реакции разложения тиосульфата натрия при прокаливании, имея в виду, что одним из продуктов является Na2S5. 21. Укажите методы получения тиосерной кислоты? Напишите уравнения соответствующих реакций. 22. Тиосерная кислота. Ее строение и окислительно-восстановительные свойства тиосульфат-иона. Напишите уравнения соответствующих реакций. 23. Какие продукты получаются при электролизе: а) разбавленного раствора серной кислоты; б) концентрированной серной кислоты? 24. Серная кислота. Ее строение, получение, кислотные и окислительные свойства. Характер взаимодействия с металлами и неметаллами. Проиллюстрируйте реакциями. 25. Напишите уравнения реакций взаимодействия концентрированной серной кислоты с цинком, медью, германием, углем и серой. 26. Предложите схему получения оксида серы (VI) из медного купороса. Напишите уравнения соответствующих реакций. 27. Охарактеризуйте изменение кислотных и окислительных свойств в ряду серная - теллуровая кислоты? 28. Что такое олеум? Какова его химическая природа? Что такое полисерные кислоты? 29. Олеум перевозят в железных цистернах. Можно ли заменить их свинцовыми или медными? Почему олеум не растворяет железо? 30. Можно ли осушить сероводород, оксид серы (IV) и аммиак, пропуская их через концентрированную серную кислоту? 31*. Можно ли растворить сульфат кальция в серной кислоте? 32*. Предложите схему получения сероводорода из сульфата кальция. 33. Укажите способы получения пиросульфата калия. 34*. Предложите схему получения оксида серы(IV) из сульфата цинка. 35. Приведите примеры пероксидных соединений серы. 36. Напишите структурную формулу надсерной кислоты. 37. Напишите уравнения реакций взаимодействия надсерной кислоты с: а) пероксидом водорода; б) водой? 38*. Можно ли приготовить персульфат железа(II)? Почему? Напишите уравнение соответствующей реакции. 39*. Почему мононадсерная кислота является одноосновной? 40. Напишите уравнение реакции получения какой- либо тиосоли. 41. Составьте уравнения реакций: a) Sb2S3 + Na2S→ б) As2S5 + Na2S →
в) Sb2S3 + NaOH→ г) CdS + HCl(избыток)→ 42. Сравните свойства сернистой, селенистой и теллуристой кислот. Напишите уравнения соответствующих реакций. 43. Охарактеризуйте изменение окислительных свойств при переходе от серной к теллуровой кислоте? 44*. Напишите формулу шестиосновной кислоты, которую образует один из элементов подгруппы серы. Почему другие элементы этой подгруппы не образуют подобных кислот? 45*. Имеются разбавленные растворы двух кислот: серной и селеновой. Как отличить эти кислоты? Напишите уравнения соответствующих реакций. 46. Напишите уравнения реакций, при помощи которых можно осуществить превращения: а) S→ H2S→ Na2S→ SO2→ S; б) SO2→NaHSO3→ Na2SO3 →Na2SO4 →NaHSO4→ Na2S2O7; в) NaHSO3→Na2S2O3→ NaHSO3 →Na2SO3→ Na2S2O3→ Na2S4O6. 47. Закончите уравнения реакций: 1) S + NaOH → Na2SO3 +... 2) K2S + KMnO4 + H2O → 3) Na2SO3 + KMnO4 + H2SO4 → 4) (NH4)2S2O8 + MnSO4 + H2O →HMnO4 +... 5) H2S + SO2 + NaOH → Na2S2O3 +... 6) Cu + H2SO4(конц.) → 7) Zn + H2S2O7 → H2S +... 8) Hg + H2SO4 (конц.) → 9) Na2S2O3 + Al + HCl → H2S +... 10) Zn + H2SO4(конц.)→ 11) K2S4O6 + H2O2 → 12) Se + HNO3 + H2O → 13) Te + HNO3 → 14) TeO2 + KOH→ 15) TeO2 + H2O2 + H2O→ 16) Na2S2O3 + I2→ 17) Na2S2O3 + Cl2→ 18) H2SeO4 (конц.)+ Au→ 19) Se + NaOH→ 20) SO2 + SeO2 → 21) Na2SeO3 + HI→ 48. Какой объем концентрированной серной кислоты плотность. 1,84 г/мл, в которой массовая доля кислоты составляет 98%, необходимо взять для полного растворения меди массой 8 г? Какой объем оксида серы (IV), измеренного при нормальных условиях, выделится при этом? Ответ:13.6 мл; 2,8 л. 49. Какой объем оксида серы (IV), измеренный при температуре 27 ºС и давлении 98,5 кПа, образуется при обжиге пирита массой 30 г, который кроме дисульфида железа (FeS2) содержит примеси, не образующие при обжиге SО2? Массовая доля примесей в пирите составляет 20%. Ответ:10,1 л. 50. На смесь сульфида цинка, хлорида натрия и карбоната кальция массой 80 г подействовали избытком соляной кислоты. При этом образовалась смесь газов объемом 13,44 л (н.у.). При взаимодействии этой газовой смеси с избытком оксида серы (IV) образовалось твердое вещество массой 19,2 г. Определите массовые доли веществ в исходной смеси. Ответ: 0,485; 0,25; 0,265. Элементы VA подгруппы N, P, As, Sb, Bi Атомы элементов имеют электронную конфигурацию валентных уровней ns2p3, и проявляют степени окисления (–3, +3, +5) Физические свойства
Азот Известен с 1772 года, содержание в земной коре – 0,03%, в воздухе - 75,5% (по массе) или 1015 т. Получение. Азот и другие газы – компоненты воздуха – в промышленности получают методом фракционной перегонки жидкого воздуха. Лабораторный способ. Разложение нитрита или бихромата аммония: NH4NO2 (NH4)2Cr2O7
Химические свойства. Молекула азота двухатомна (N≡N) очень устойчива, поэтому обладает низкой реакционной способностью. Реагирует с простыми веществами лишь при очень высоких температурах (>1000 ºC), образует нитриды, проявляет степень окисления –3.
Изменение свойств нитридов по периоду:
Na3N + H2O = NaOH + NH3 Cl3N + H2O = HClO + NH3 Водородные соединения. NH3 - аммиак - газ, с характерным запахом; сжижается при –33°С, затвердевает при – 78°С, хорошо растворяется в воде: при 0°С – растворяется1200 объемов NH3 в одном объеме H2O, а при 20°С ~700 объемов NH3 в одном объеме H2O. Аммиак имеет большую теплоту испарения (5,6 Ккал/моль). При его испарении происходит сильное охлаждение (холодильники). Получение Лабораторный способ. Действием на соли аммония щелочи: (NH4)2SO4 + 2NaOH = 2NH3↑+ 2H2O + Na2SO4 Промышленный способ. В технике (метод Габбера, предложен в 1913г.) эндо N2 + 3H2 D 2NH3 (ΔH = –92KДж) экзо
Процесс проводят при 500-600°С и давлении 100 МПа в присутствии катализаторов. Химические свойства аммиака Для NH3 характерны реакции: 1 – присоединения (самые характерные), 2 – замещения, 3 – окисления. Примеры: Реакции присоединения NH3 + H2O = NH4OH NH3 + HCl = NH4Cl [Ag(NH3)2]Cl, [Co(NH3)4]Br2 NH3 – лиганд (донор электронной пары) Реакции замещения - менее характерны. Водород NH3 может последовательно замещатся: NH3 ═ NH ─NH2 ≡ N имино-группа амино-группа
2Al + 2NH3 = 2AlN + 3H2 2Na + 2NH3 = 2NaNH2 + H2 нитрид алюминия амид натрия
Водород NH3 может замещаться галогенид-ионом. Например, при получении иодида азота (в сухом состоянии взрывоопасен):. 2NH4OH + 3I2 = 2NI3 + 6HI + 2H2O 2NI3 (2NH3∙2H2O)
Существуют и другие производные аммиака: NH2OH – гидроксиламин; N2H4 - гидразин, H[N3] - азид водорода (азотистоводородная кислота H ─ N ═ N ≡ N - слабее уксусной). Все они проявляют восстановительные свойства, могут быть окислены до свободного азота N2, но при взаимодействии с водородом могут выступать окислителями, переходя в NH3. Реакции окисления (NH3 -восстановитель слабый): 4NH3 + 3O2 = 6H2O + 2N2 (без катализатора) 4NH3 + 5O2 Все водородные соединения азота - восстановители (N2), но могут быть (за исключением NH3) могут быть и окислителями:
NH2OH 2NH2OH – 2ē = N2 + 2H+ NH3 H[N3] 2H[N3] – 2ē =3N2 + 2H+
Примеры. 10H[N3] + 2KMnO4 + 3H2SO4 = 15N2 + K2SO4 + 2MnSO4 + 8H2O восстановитель
H[N3] + 4H2 = 3NH3 окислитель
Кислородные соединения азота. Ниже приведены оксиды азота, их агрегатное состояние, соответствующие им кислоты и соли: +1 +2 +3 +4 +5 N2 NO N2O3 NO2 N2O5 газ газ жидкость до –1° газ твердое вещество несолеобразующие ↓ '(↓ (HNO2) HNO3 азотистая азотная соли-нитриты нитраты
Азотная кислота Бесцветная жидкость, ρ = 1,52 г/мл, при –42°С застывает, сильная кислота, сильнейший окислитель. Получение HNO3 1) Из аммиака (NH3): a) 4NH3 + 5O2 б) NO 2) Из воздуха (дуговой метод: струя воздуха - через дугу (~ 4000°) и быстрое охлаждение до1200°С): N2 + O2 D 2NO 2NO + O2 D 2NO2 4NO2 + 2H2O + O2 = 4HNO3
Взаимодействие азотной кислоты с металлами и неметаллами
Нитраты - окислители в щелочной среде: & NO3– (
KNO3 + 4Zn + 7KOH
Примеры взаимодействия концентрированной HNO3 с неметаллами:
I2 → HIO3...... S → H2SO4 P + HNO3(конц.) → H3PO4 + NO +.... As → H3AsO4...... Sb → H3SbO4.......
Смесь кислот (HNO3 + 3HCl) - царская водка, в ней растворяются даже платина и золото: Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 1256; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.192.3 (0.175 с.) |
 SeO2 Te + O2
SeO2 Te + O2  S+4
S+4  S+6
S+6 Se4+,Te4+
Se4+,Te4+  S+6
S+6 Na2TeO4
Na2TeO4 1,6·10 –11 моль/л
1,6·10 –11 моль/л моль/л.
моль/л. моль; n(H2SO4) = 2n(Cu) = 0,125·2 = 0,25 моль.
моль; n(H2SO4) = 2n(Cu) = 0,125·2 = 0,25 моль.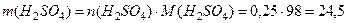 г;
г; г;
г;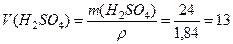 мл;
мл;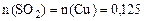 моль;
моль;  л.
л. n(FeS2) =
n(FeS2) =  моль.
моль.
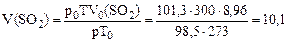 л.
л. N2 + 3I2
N2 + 3I2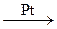 6H2O + 4NO (с катализатором)
6H2O + 4NO (с катализатором)
 N2H4
N2H4  N2H4 – 4ē = N2 + 4H+
N2H4 – 4ē = N2 + 4H+ 4NO + 6H2O
4NO + 6H2O NO2
NO2  HNO3
HNO3 NO2–
NO2–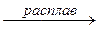 NH3 или NO2#
NH3 или NO2# NH3 + 4K2ZnO2 + 2H2O
NH3 + 4K2ZnO2 + 2H2O


