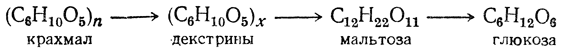Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Очистка белков от низкомолекулярных примесей методом диализа.Содержание книги
Поиск на нашем сайте
Фотоэлектроколориметр Для измерения оптической плотности или светопропускания жидких растворов по отношению к растворителю или стандартному раствору предназначен фотоэлектрический колориметр (ФЭК). В основу работы этого прибора положен принцип уравнения интенсивности двух световых пучков, проходящих через оптические среды, при помощи переменной щелевой диафрагмы. Световые лучи от лампы, отразившись от зеркал, проходят через светофильтры, кюветы и попадают на фотоэлементы, которые подключены к гальванометру. Так что при равенстве интенсивности падающих на фотоэлементы световых пучков стрелка гальванометра стоит на нуле. При вращении барабана диафрагма, связанная с ним, меняет свою ширину и тем самым величину светового потока, падающего на фотоэлемент. Фотометрически нейтральный клин служит для ослабления светового потока, падающего на фотоэлемент. Способ измерения. 1.В пучок света помещают кюветы с контрольным раствором. 2.Вращением ручки круговых фотометрических клиньев устанавливают стрелку гальванометра на нуль. 3.Затем в пучок света вводится кювета с исследуемым раствором, при этом стрелка гальванометра отклоняется от нулевого положения. Снимается показание. 4.Прибор после окончания работы выключить. Осторожно промыть кюветы. Термоста́т — прибор для поддержания постоянной температуры. Поддержание температуры обеспечивается либо за счёт использования терморегуляторов, либо осуществлением фазового перехода (например, таяние льда) Песчаные бани используют при необходимости в ещё более высоких температурных показателях. Они, по сути, являются лотками с двумя термоэлектрическими нагревателями, куда засыпают кварцевый песок. Обрабатываемые образцы помещаются в рабочую зону, образуемую 10-15 мм равномерно прогретого верхнего слоя. Эксплуатационные преимущества таких приборов очевидны: экономичное энергопотребление, простота в обслуживании и высокая равномерность прогрева теплоносителя. лабораторные водяные бани обеспечивают более равномерное нагревание. Принцип их действия прост: сосуд с исследуемым материалом погружается в жидкость или, в случае с паровыми моделями, охватывается её парами. Поскольку в условиях нормального атмосферного давления температура кипения не превышает 100°C, её предельное значение устанавливается автоматически. Если силу нагрева требуется увеличить, они могут наполняться маслом или парафином (для t° до 250°С). Гидролиз казеина и открытие в гидролизате фосфорной кислоты. Ход работы. 100 мг порошка казеина растворяют в пробирке в 3 мл 10% раствора едкого натра или кали. Пробирку закрывают пробкой со стеклянной трубкой в качестве холодильника, закрепляют ее на асбестовой сетке металлической лапкой и нагревают. Через час после начала кипения жидкости гидролиз прекращают, жидкости дают остыть и нейтрализуют ее концентрированной азотной кислотой (12-15 капель) до слабокислой реакции на лакмус. При нейтрализации выпадает осадок высокомолекулярных продуктов неполного гидролиза белков (пептоны). После отстаивания жидкость фильтруют, с фильтром проделывают молибденовую пробу на фосфорную кислоту (к 20 каплям молибденового реактива добавляют 2-3 капли гидролизата и кипятят несколько минут на голом огне). Выпадает небольшой кристаллический осадок фосфорномолибденовокислого аммония (лимонно-желтого цвета). 12(NH4)2·Mo O4 + H3PO4 + 21HNO3 → (NH4)3PO4·12Mo O3 + 21 NH4NO3 + 12 H2O желтый кристаллический осадок
Очистка белков от низкомолекулярных примесей методом диализа. Принцип метода основан на неспособности молекул белка (коллоидных частиц) проникать через полупроницаемую мембрану (пергамент, целлофан, колодий и др.), в то время как низкомолекулярные примеси легко проходят через поры этих мембран. Метод диализа широко используется для разделения и очистки белков и других биополимеров от примесей солей и низкомолекулярных органических соединений. Основанный на этом же принципе метод гемодиализа (вивидиффузия), применяется для лечения больных с почечной недостаточностью (аппарат «искусственная почка»). Ход работы. В подготовленный колодиевый или целлофановый мешочек поместить 1 мл сыворотки крови (раствора яичного белка) и 3-4 мл 6% раствора хлористого натрия, аккуратно поместить их в стакан с дистиллированной водой. Через 30-60 минут с небольшими порциями диализируемого раствора белка (содержимое мешочка) и диализата (наружная жидкость) провести пробы на хлориды и белок, чтоб удостовериться в том, что соль диффундировала, а белок остался в мешочке. Для обнаружения белка провести биуретовую реакцию. Принцип метода. Реакция основана на способности пептидной группы белков и полипептидов образовывать с ионами меди в щелочной среде комплексные соединения фиолетового цвета. Реакция позволяет обнаружить наличие пептидной связи в исследуемом веществе и, следовательно, является универсальной реакцией для обнаружения веществ белковой природы. Свое название реакция получила от производного мочевины биурета, который дает в данных условиях то же окрашивание, что и белок. Техника проведения работы. В пробирку добавить 5 капель раствора белка, 10 капель раствора едкого натра и 1 каплю раствора сульфата меди. Отметить появление красно-фиолетового окрашивания. Для обнаружения хлоридов к 0,5-1 мл раствора добавить 1-2 капли 1% раствора азотной кислоты и 1-2 капли 1% раствора азотнокислого серебра и отметить выпадение творожистого осадка.
Построение калибровочного графика. Для этого применяют стандартный белок – альбумин сыворотки крови. Из 10% стандартного раствора альбумина в 4 пробирках готовят растворы белка как показано в таблице.
Из каждой пробирки берут по 0,1 мл раствора, добавляют к нему 5,0 мл биуретового реактива. Через 30 мин. измеряют экстинкцию на ФЭКе против контрольного раствора (0,1 мл 0,9% раствора хлорида натрия и 5 мл биуретового реактива). Полученные значения откладывают на оси ординат, а концентрацию белка (в г/л) на оси абсцисс.
Количественное определение белка в моче по методу Количественное определение белка в моче по методу Специфичность ферментов. Одно из более характерных свойств ферментов - их высокая специфичность. Ферменты специфичны как в отношении типа катализируемых реакций, так и в отношении субстратов, на которые они воздействуют. Большинство ферментов обладает абсолютной специфичностью, действуя только на какой-либо один субстрат. Высокая специфичность ферментов определяется соответствием пространственной конфигурации активного центра фермента и субстрата. Амилаза слюны ускоряет гидролиз только полисахаридов (таких как крахмал, гликоген) до мальтозы, но не оказывает действие на дисахариды. Гидролиз крахмала под влиянием ферментов слюны идет согласно схеме:
Гидролиз крахмала под действием амилазы проходит через стадию образования декстринов. Крахмал дает с йодом синее окрашивание, амилодекстрины («осколки», образующиеся после гидролиза некоторых внутренних гликозидных связей)- фиолетовое, эритро- и ахродекстрины (олигосахариды с меньшей молекулярной массой) – соответственно красно-бурое и желтое (цвет йода в воде). Конечные продукты гидролиза – мальтоза и глюкоза – имеют свободные альдегидные группы и дают реакцию Троммера, которая основана на способности углеводов при нагревании восстанавливать гидрат окиси меди (голубого цвета) в гидрат закиси (желтого цвета). При дальнейшем нагревании гидрата закиси переходит в красную закись меди. О расщеплении крахмала можно судить на основании двух реакций: 1) реакции на крахмал с йодом и 2) реакции Троммера. Сахароза не имеет свободной?альдегидной или кетонной группы, поэтому не дает реакции Троммера. Реакция Троммера может быть положительной только в том случае, если сахароза расщепится на свои составные части – глюкозу и фруктозу.
Порядок выполнения работы Споласкивают рот, в чистую пробирку собирают 2-3 мл слюны, которую разводят в 5 раз. В две пронумерованные пробирки приливают по 5 капель разведенной слюны. В 1 пробирку добавляют 10 капель 1% раствора крахмала, во 2- 10 капель 1% раствора сахарозы. Обе пробирки помещают на 10 минут в термостат или водную баню при температуре 38оС, после чего содержимое пробирок делят на 2 части, с одной проделывают реакцию на крахмал, с другой реакцию Троммера. Реакция Троммера К 5 каплям исследуемой жидкости прибавляют 5 капель 10% раствора NaOH и 5 капель раствора CuSO4 и нагревают. В присутствии глюкозы и мальтозы выпадает желтый осадок гидрата закиси меди или красный осадок закиси меди. Полученный результат занести в таблицу.
Сделайте вывод о субстратной специфичности фермента.
Термолабильность ферментов. Большинство ферментов термолабильны - при нагревании до 60-80о утрачивают каталитическую активность. Степень инактивирования зависит от длительности теплового воздействия. При низких температурах ферменты хорошо сохраняются, но скорость ферментативного катализа снижается. В термолабильности ферментов можно убедиться на примере действия ферментов слюны: амилазы и мальтазы. Порядок выполнения работы В чистую пробирку отливают небольшое количество разведенной слюны (2-3мл) и кипятят ее в течение 5-8 минут, после чего охлаждают В 3 пронумерованные пробирки наливают по 10 капель 1% раствора крахмала. В 1 пробирку добавляют 10 капель слюны, разведенной в 5 раз, во 2-ю 10 капель прокипяченной слюны, в 3-ю 10 капель воды (качестве контроля). Все пробирки помещают в термостат или водяную баню при температуре 38она 10 минут. После этого проделывают качественные реакции на крахмал и реакцию Троммера на продукты расщепления. Реакция на крахмал. К 5 каплям исследуемого раствора приливают 1 каплю раствора йода в йодистом калии. В присутствии крахмала появляется синее окрашивание. Полученный результат занести в таблицу.
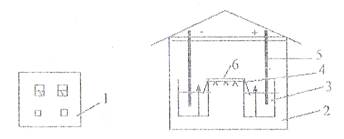
Порядок выполнения работ В 7 предварительно пронумерованных пробирок наливают 0,2 м раствор двузамещенного фосфорнокислого натрия и 0,1 м раствор лимонной кислоты в соотношениях, указанных в таблице. Получают буферные растворы с рН от 5,6 до 8,0. В каждую пробирку добавляют по 10 капель 1% раствора крахмала, по 10 капель слюны, разведенной в 100 раз. Перемешивают содержимое пробирок и помещают их в водяную баню или термостат при температуре 38о на 5-10 минут (в зависимости от индивидуальных особенностей активности слюны). Реакция с серной кислотой. В пробу налить 1 каплю масляного раствора витамина Д, 4 капли хлороформа, перемешать и добавить 2 капли концентрированной серной кислоты. Встряхнуть и отметить появление ярко-желтого окрашивания, переходящего в буро-красное. Качественная реакция на витамин Е с азотной кислотой. В сухую пробирку налить 5 капель 1% раствора токоферола, прибавить 10 капель концентрированной азотной кислоты и встряхнуть. После отстаивания эмульсии отметить появление красного окрашивания в верхнем слое. Проба Яффе на уробилин. К 2 мл мочи прибавить небольшую порцию раствора хлористого цинка. При встряхивании появляется хлопьевидный осадок, который растворить в концентрированном растворе аммиака (около 1мл). В норме появляется слабо-зеленая флюоресценция, ярко выраженная при патологии. Порядок выполнения работы 1. Устройство прибора для электрофореза. Прибор состоит из выпрямителя, подающего постоянный ток необходимого напряжения, и камеры для электрофореза. Сама камера состоит из 2-х ванн; в одной из них имеется неподвижная перегородка, куда помещается платиновый электрод (+ анод), а в другой находится электрод из нержавеющей стали (- катод). Между ваннами, заполненными соответствующим буфером, имеется соединительный мост, на который помещают полоски специальной фильтровальной бумаги. 2. Проведение электрофореза. Заполнить обе ванны камеры раствором вероналового буфера с pH 8,6. Буферного раствора в ваннах должно быть столько, чтобы он покрывал неподвижную перегородку, но был ниже подвижных перегородок. Вставить в ванны электроды. Вырезать из фильтровальной бумаги полосы необходимого размера в зависимости от величины камеры (обычно шириной 4-6 см) и простым карандашом отметить место, на которое впоследствии будет наноситься сыворотка (старт). Смочить эти полоски в вероналовом буфере. Вставить в ванны-камеры соединительный мост. Поместить полоски бумаги на сухие пластинки щипцами, погрузив концы полосок в ванны с буфером, и на заранее отмеченные участки бумаги нанести сыворотку по 0,025-0,005 мл на расстоянии 5-6 см от края моста. Нанесение сыворотки производится со стороны катода.
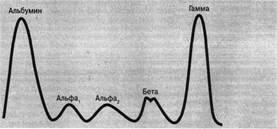
Рисунок 1. Схема камеры для электрофореза белков на бумаге: 1-стабилизатор; 2-камера для электрофореза; 3-буферный раствор; 4-поддерживающий соединительный мост-электрод; 5-фильтровальная бумага для электрофореза. После нанесения на бумажные полоски сыворотки камера герметично закрывается крышкой. На крышке камеры расположен прижим блокировки, служащий для включения камеры. Присоединенный выпрямитель подает к камере постоянный ток от 2 до 4 мА при постоянном напряжении 110-160В. Электрофорез проводят при градиенте потенциала от 3 до 8 В на 1 см полосы при комнатной температуре. Хорошее разделение происходит за 18-20 часов. 3. Выключение прибора и выявление белковых фракций. Выключают прибор. Снимают камеры и извлекают бумажные полоски из прибора. Затем каждую полоску помещают в сушильный шкаф на 20 минут при температуре 1050С. При этом происходит фиксация белковых фракций на бумаге. Окраску белков проводят раствором бромфенолового-синего в течение 30 минут, затем промывают электрофореграммы 2% раствором уксусной кислоты. Полученные электрофореграммы сушат на воздухе. Белковые фракции окрашиваются в сине-зеленый цвет. 4. Количественное определение белковых фракций. Окрашенные белковые пятна вырезают, краситель элюируют 0,01 н раствором щелочи. Интенсивность окраски каждой фракции определяют колориметрически на ФЭКе. Количественное определение белковых фракций на электрофореграмме можно установить двумя способами: путем элюирования краски и фотоколориметрирования и денситометрическим методом. Содержание белковых фракций сыворотки крови, полученное с помощью электрофореза на бумаге, в среднем составляет у взрослого человека: альбумины 55,4-65,9 % α1-глобулины 3,4-4,7 % α2-глобулины 5,5-9,5 % β-гдобулины 8,9-12,6 % γ-глобулины 13-22,2 % Денситометрический метод. В специальном аппарате (денситометре) через электрофореграмму пропускают пучок света, поглощение которого зависит от оптической плотности окрашенных белковых пятен. Свет, прошедший через электрофореграмму, улавливается фотоэлементом и превращается в электрический ток, колебания которого фиксируют на бумажном листе в виде кривой, каждый пик кривой соответствует определенной белковой фракции.
Рисунок 2. Электрофореграмма сыворотки человека.
По Вольгемуту. Амилаза - фермент, осуществляющий гидролитическое расщепление полисахаридов до декстринов и мальтозы (химизм реакции см. занятие№6). Конечные продукты действия амилазы не дают цветной реакции с йодом. Наиболее богаты амилазой слюнные и поджелудочная железы. Клинико-диагностическое значение имеет определение активности амилазы в крови, куда она попадает из поджелудочной железы (40%) и слюнных желез (60%). Амилазная активность крови по Вольгемуту в норме составляет 25-125 Ед/л. При остром панкреатите в первые сутки заболевания активность амилазы крови возрастает в десятки раз, а затем постепенно возвращается к норме. Амилазная активность крови увеличивается также при паротите (воспалении слюнных желез). Амилаза имеет небольшую молекулярную массу – 45 000, поэтому легко проходит почечный фильтр и попадает в мочу. В связи с меньшей инвазивностью определение амилазной активности мочи (диастазный тест) широко используется в клинике для диагностики состояния поджелудочной железы (см. УИРС). Принцип метода. Метод основан на том, что слюну разводят в определенной последовательности, после чего приливают одно и тоже количество раствора крахмала и находят наименьшее содержание фермента, которое полностью расщепляет все количество добавленного крахмала. Затем производят перерасчет активности фермента на 1 мл слюны. Амилазная активность слюны или амилокластичекая сила слюны выражается количеством 0,1% раствора крахмала в мл, которое может расщепляться 1 мл слюны при температуре 380 в течении 30 мин. В норме амилазная активность слюны составляет 160-320 ед. Ход работы. В 10 пронумерованных пробирок наливают по 1 мл воды. Затем в первую пробирку добавляют 1 мл слюны, разведенной в 10 раз. Содержимое первой пробирки перемешивают и 1 мл раствора (суммарное разведение в 20 раз) переносят из 1-й пробирки во вторую, перемешивают(рслюна разведена в 40 раз). Затем 1 мл разведенной слюны из второй переносят в третью и.т.д. - из предыдущей пробирки в следующую. Из 10 пробирки 1 мл смеси выливают. Таким образом, получается ряд разведенной слюны, в котором в каждой последующей пробирки содержание фермента вдвое меньше, чем в предыдущей. Во все пробирки добавляют по 1 мл воды и по 2 мл 0,1% раствора крахмала, перемешивают и помещают пробирки в термостат на 30 мин при температуре 380. Через 30 минут пробирки вынимают, охлаждают, добавляют по 1-2 капле 1% раствора йода и перемешивают. Жидкость в пробирках в зависимости от степени расщепления крахмала может окрашиваться в желтый, розовый, красный и фиолетовый цвет. Раствор желтого цвета свидетельствует о полном расщеплении крахмала, фиолетовый – о том, что крахмал в растворе еще сохранился. Работу необходимо оформить в виде таблицы.
Расчет. Берется количество слюны в последней пробирке с желтой окраской. Если это четвертая пробирка, то разведение слюны в ней – 160 раз. Составляется пропорция: 1). 160 мл слюны расщепляет 2 мл 0,1% р-ра крахмала; 2) 1 мл слюны расщепляет Х мл 0,1% р-ра крахмала, т.е. амилокластическая активность слюны составляет 320 ед.
Техника выполнения работы. Определение АсАТ. Одновременно готовят опытную и контрольную пробы. Опытная проба. В пробирку вносят 0,5 мл субстратного раствора, добавляют 0,1 мл сыворотки, помещают в термостат при температуре 37° С на 1 час. Затем добавляют 0,5 мл раствора динитрофенилгидразина и выдерживают при комнатной температуре 20 мин для развития реакции. Затем приливают 5 мл 0,4 н NaOH, тщательно перемешивают и оставляют при комнатной температуре на 10 мин для развития окраски. Оптическую плотность измеряют на ФЭКе с зеленым светофильтром в кювете на 10 мм против контроля. Контрольная проба. Содержит все ингредиенты опытной пробы за исключением сыворотки крови. Вместо нее берут 0,1 мл дистиллированной воды и инкубируют в тех же условиях, что и опытную. Определение АлАТ. Одновременно готовят опытную и контрольную пробы. В опытную пробирку вносят 0,5 мл субстратного раствора для определения АлАТ, затем добавляют 0,1 мл испытуемой сыворотки и помещают в термостат при температуре 37° С на 30 мин. Дальнейший ход анализа такой же, как при определении АсАТ. В контрольную пробирку вместо сыворотки крови берут 0,1 мл дистиллированной воды. Расчет активности ферментов производят по калибровочному графику, отражающему зависимость оптической плотности от содержания ПВК.
Принцип определения: в результате сжигания безбелкового фильтрата крови азот низкомолекулярных азотистых соединений переходит в состав иона NH4. Количество азота устанавливается по количеству кислоты, необходимой для связывания образовавшегося аммония. В норме азот остаточный составляет 20— 40 мг%. Увеличение содержания азота остаточного в крови наступает при нарушении функции почек, печени, при усиленном распаде тканей (гангрена, туберкулез, злокачественные опухоли). Принцип метода. Основан на том, что мочевина с гипохлоритом натрия и фенолом образует продукт зеленого окрашивания. Ход работы. В пробирку поместить 0,1 мл разведенной в 100 раз исследуемой мочи, добавить 7 мл этилового спирта и прилить 2 мл дистиллированной воды. К полученной смеси прибавить 1 мл 0,035 н раствора НСl, тщательно перемешать, добавить 1 мл 1,2 % NaOCl, вновь тщательно перемешать и сразу же добавить 1 мл 5 % раствора фенола. Содержимое пробирки хорошо перемешать и поместить на 25 мин в термостат при температуре 55-60° С. Окрашенный в зеленый цвет раствор охладить и колориметрировать на ФЭКе с красным светофильтром в кюветах толщиной 5 мм против воды. Концентрацию мочевины рассчитать с помощью калибровочного графика с учетом разведения мочи и суточного диуреза (1500-2000 мл). Принцип в крови Мочевина под действием уреазы разлагается на углекислый газ и аммиак, который в щелочной среде с гипохлоритом натрия и фенолом образует индофенол синего цвета (метод Бертло). Светопоглощение образовавшегося продукта пропорционально содержанию мочевины в образце.
Техника выполнения работы. В центрифужные пробирки вносят 1 мл сыворотки крови, добавляют 8 мл дистиллированной воды, 0,5 мл 0,35М серной кислоты, перемешивают. Затем добавляют 0,5 мл 10% раствора вольфрамата натрия, опять переемешивают и через 10 мин. Центрифугируют в течение 10 мин при 1500 об/мин. После осаждения белков сыворотки крови центрифугированием ставят опытную, стандартную и контрольную пробы. Опытная проба: 3 мл надосадочной жидкости переносят в чистую прбирку. Стандартная проба: 3 мл 0,03М стандартного раствора мочевой кислоты (1 мл содержит 0,006 ммоль мочевой кислоты) налить в чистую пробирку. Контрольная проба: В чистую пробирку прилить 3 мл дистиллированной воды. Во все три пробирки добавляют 1,5 мл 10,3% раствора карбоната натрия, 1 мл фосфорновольфрамового реактива, тщательно перемешивают и через 30 мин опытную и стандартную пробы фотометрируют при длине волны 590-700 нм (красный светофильтр) в кювете длиной оптического пути 1 см против контрольной пробы. Расчет: концентрацию мочевой кислоты рассчитывают по формуле: С= Еопыт./Естанд.×Естанд.×10, где С – концентрация мочевой кислоты, ммоль/л; Еопыт. – экстинкция опытной пробы; Естанд.- экстинкция стандартной пробы; Сстанд. – концентрация стандартного раствора мочевой кислоты, 0,03 ммоль/л; 10 – коэффициент пересчета на объём сыворотки крови.
Проба Яффе на уробилин. К 2 мл мочи прибавить небольшую порцию раствора хлористого цинка. При встряхивании появляется хлопьевидный осадок, который растворить в концентрированном растворе аммиака (около 1мл). В норме появляется слабо-зеленая флюоресценция, ярко выраженная при патологии. Фотоэлектроколориметр Для измерения оптической плотности или светопропускания жидких растворов по отношению к растворителю или стандартному раствору предназначен фотоэлектрический колориметр (ФЭК). В основу работы этого прибора положен принцип уравнения интенсивности двух световых пучков, проходящих через оптические среды, при помощи переменной щелевой диафрагмы. Световые лучи от лампы, отразившись от зеркал, проходят через светофильтры, кюветы и попадают на фотоэлементы, которые подключены к гальванометру. Так что при равенстве интенсивности падающих на фотоэлементы световых пучков стрелка гальванометра стоит на нуле. При вращении барабана диафрагма, связанная с ним, меняет свою ширину и тем самым величину светового потока, падающего на фотоэлемент. Фотометрически нейтральный клин служит для ослабления светового потока, падающего на фотоэлемент. Способ измерения. 1.В пучок света помещают кюветы с контрольным раствором. 2.Вращением ручки круговых фотометрических клиньев устанавливают стрелку гальванометра на нуль. 3.Затем в пучок света вводится кювета с исследуемым раствором, при этом стрелка гальванометра отклоняется от нулевого положения. Снимается показание. 4.Прибор после окончания работы выключить. Осторожно промыть кюветы. Термоста́т — прибор для поддержания постоянной температуры. Поддержание температуры обеспечивается либо за счёт использования терморегуляторов, либо осуществлением фазового перехода (например, таяние льда) Песчаные бани используют при необходимости в ещё более высоких температурных показателях. Они, по сути, являются лотками с двумя термоэлектрическими нагревателями, куда засыпают кварцевый песок. Обрабатываемые образцы помещаются в рабочую зону, образуемую 10-15 мм равномерно прогретого верхнего слоя. Эксплуатационные преимущества таких приборов очевидны: экономичное энергопотребление, простота в обслуживании и высокая равномерность прогрева теплоносителя. лабораторные водяные бани обеспечивают более равномерное нагревание. Принцип их действия прост: сосуд с исследуемым материалом погружается в жидкость или, в случае с паровыми моделями, охватывается её парами. Поскольку в условиях нормального атмосферного давления температура кипения не превышает 100°C, её предельное значение устанавливается автоматически. Если силу нагрева требуется увеличить, они могут наполняться маслом или парафином (для t° до 250°С). Гидролиз казеина и открытие в гидролизате фосфорной кислоты. Ход работы. 100 мг порошка казеина растворяют в пробирке в 3 мл 10% раствора едкого натра или кали. Пробирку закрывают пробкой со стеклянной трубкой в качестве холодильника, закрепляют ее на асбестовой сетке металлической лапкой и нагревают. Через час после начала кипения жидкости гидролиз прекращают, жидкости дают остыть и нейтрализуют ее концентрированной азотной кислотой (12-15 капель) до слабокислой реакции на лакмус. При нейтрализации выпадает осадок высокомолекулярных продуктов неполного гидролиза белков (пептоны). После отстаивания жидкость фильтруют, с фильтром проделывают молибденовую пробу на фосфорную кислоту (к 20 каплям молибденового реактива добавляют 2-3 капли гидролизата и кипятят несколько минут на голом огне). Выпадает небольшой кристаллический осадок фосфорномолибденовокислого аммония (лимонно-желтого цвета). 12(NH4)2·Mo O4 + H3PO4 + 21HNO3 → (NH4)3PO4·12Mo O3 + 21 NH4NO3 + 12 H2O желтый кристаллический осадок
Очистка белков от низкомолекулярных примесей методом диализа. Принцип метода основан на неспособности молекул белка (коллоидных частиц) проникать через полупроницаемую мембрану (пергамент, целлофан, колодий и др.), в то время как низкомолекулярные примеси легко проходят через поры этих мембран. Метод диализа широко используется для разделения и очистки белков и других биополимеров от примесей солей и низкомолекулярных органических соединений. Основанный на этом же принципе метод гемодиализа (вивидиффузия), применяется для лечения больных с почечной недостаточностью (аппарат «искусственная почка»). Ход работы. В подготовленный колодиевый или целлофановый мешочек поместить 1 мл сыворотки крови (раствора яичного белка) и 3-4 мл 6% раствора хлористого натрия, аккуратно поместить их в стакан с дистиллированной водой. Через 30-60 минут с небольшими порциями диализируемого раствора белка (содержимое мешочка) и диализата (наружная жидкость) провести пробы на хлориды и белок, чтоб удостовериться в том, что соль диффундировала, а белок остался в мешочке. Для обнаружения белка провести биуретовую реакцию. Принцип метода. Реакция основана на способности пептидной группы белков и полипептидов образовывать с ионами меди в щелочной среде комплексные соединения фиолетового цвета. Реакция позволяет обнаружить наличие пептидной связи в исследуемом веществе и, следовательно, является универсальной реакцией для обнаружения веществ белковой природы. Свое название реакция получила от производного мочевины биурета, который дает в данных условиях то же окрашивание, что и белок. Техника проведения работы. В пробирку добавить 5 капель раствора белка, 10 капель раствора едкого натра и 1 каплю раствора сульфата меди. Отметить появление красно-фиолетового окрашивания. Для обнаружения хлоридов к 0,5-1 мл раствора добавить 1-2 капли 1% раствора азотной кислоты и 1-2 капли 1% раствора азотнокислого серебра и отметить выпадение творожистого осадка.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 818; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.118.194 (0.012 с.) |