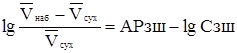Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фізико-хімічні і технологічні властивості іонітів.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Технологічні якості іонітів в значній мірі залежать від вихідної сировини, засобу виготовлення, природи обмінних іонів і умов практичного застосування. Технологія їх виготовлення складна, відступи від прийнятого засобу неминуче спричиняють отриманню іонітів нестандартної якості. Будучи споживачем іонітів і не маючи можливості впливати на якість промислових зразків, технологи ВПУ повинні контролювати якість кожної нової партії – це необхідно для правильного вибору й економічного й ефективного режиму їх використання. Для однакової оцінки якості іонітів, методи визначення показників уніфікуються у вигляді відповідності Держстандартам, методикам визначення певних властивостей. Якість іонітів визначається фізико-механічними, хімічними і технологічними властивостями. Фізико-механічні властивості. 1. Фізична форма іонітів - грає істотну роль, тому що від цього залежать умови зіткнення розчину електроліту з іонітом. Промислові та експериментальні зразки виготовляються переважно у вигляді сферичних гранул або зерен неправильної форми, існують порошкоподібні іоніти і композиції у вигляді і/обм. мембран (еластичні листи), і/обм. волокна, рідкі іоніти. Сферична форма переважна, тому що: забезпечується найменший опір шару іоніту потоку води, зменшуються втрати іоніту, полегшується здійснення протиточних технологій. 2. Фракційний (гранулометричний) склад. Різноманітні фізичні і хімічні властивості зернистих іонітів, а також параметри процесів за їх участю багато в чому залежать від розмірів їхніх часток. Розмір часток впливає на перепад тиску у фільтрах і для ФЗД на повноту гідравлічного поділу шихти. За інших рівних умов із зменшенням розміру часток перепад тиску в шарі, що фільтрує, збільшується. Розміри і форма зерен також впливають на ступінь використання обмінної ємності в статичних і динамічних умовах і на розширення шару при розпушенні. На практиці важливо тому, щоб по цьому показнику іоніти відрізнялися max однорідністю, тобто найбільше кращі зерна правильної форми (особливо сферичної), що забезпечують однорідне упаковування шару і найкращі кінетичні умови процесу (max обсяг при min поверхні). З досвіду промислових і/обм. процесів відомо, що оптимальними є однорідні іоніти із середнім розміром зерен 0,5-0,7 мм. Для промислового застосування розмір часток є компромісом між швидкістю реакції обміну (яка більше з малими зернами) і вищою швидкістю потоку (яка потребує великих часток для зменшення втрат). В зв'язку з тим, що в промислових умовах синтезувати однорідні іоніти неможливо, їх попередньо фракціонують. У відповідності зі стандартними вимогами 92-95 % набухших зерен або сферичних гранул полімеризаційного типу повинна складати фракція 0,3-1,2 мм із середнім розміром зерен 0,5-0,6 мм, для поліконденсаційних іонітів - фракція 0,4-2,0 мм із середнім розміром 0,7-0,8 мм (для сферичних гранул цей показник - діаметр; для зерен неправильної форми - середній розмір поперечника зерна). Сферична форма зерен іоніту сприяє їх рівномірному розташуванню в іонообмінній колонці, чим забезпечується сприятливе розподілення рідини по перерізу фільтру. Фракційний склад звичайно визначається методом сухого або мокрого розсіву за допомогою набору сит з різними діаметрами комірок або оглядом під мікроскопом. 1 г звичайного іоніту містить близько 3700 зерен Куля: повна площа поверхні Порошкоподібні іоніти мають розмір від 0,04 до 0,07 мм, композиції у вигляді і/обм. мембран (еластичні листи товщиною 0,1-1 мм). 3. Насипна маса і насипний об'єм. Насипною масою називають масу одиниці його обсягу, виражену в г/см3 або т/м3. Розрізняють значення насипної маси в сухому або вологому стані. Під насипною масою вологого іоніту розуміють вагу 1 м3 вологого іоніту після висушування його до повітряно-сухого стану, виражену в тонах. Може бути визначена діленням насипної маси повітряно-сухого іоніту на коефіцієнт набухання (Кнаб. - відношення насипної маси іоніту у сухому стані до насипної маси іоніту у пологому стані).
Значення насипної маси іоніту mн в повітряно-сухому стані - для визначення розмірів складу для збереження. Значення mн у вологому стані - важливе для визначення розмірів і числа іонітних фільтрів. Насипний об'єм - величина, обернена насипній масі: Для катіонітів значення насипної маси - 0,5-0,9 г/см3; для аніонітів - 0,3-0,8 г/см3. Питома вага – відношення ваги тіла до об'єму тіла [Н/м3] Питомий об'єм – відношення об'єму який займає речовина до його маси [м3/кг] 4. Важливий технологічний показник – вологість. В силу гідрофільності функціональних груп волога, що утримується в іоніті, є «хімічно зв'язаною», причому спеціальне видалення цієї вологи призведе надалі при експлуатації тільки до фізичної руйнації гранул. Зовнішня волога, не пов'язана хімічно з функціональними групами, перед упаковкою може бути видалена центрифугуванням або фільтруванням. Оптимальне утримання вологи в іоніті є поступкою між кінетичними характеристиками іоніту і загальної кількості введених функціональних груп. Для зручності транспортування, іонообмінні смоли упаковують по стандартній вазі, і продають їх певними об'ємами - вже для зручності споживача. Для кожного продукту визначається і постійно коректується насипна вага вологого продукту, яка дорівнює відношенню ваги до об'єму (кг/м3). Вологість іоніту W виражається в % і визначається висушуванням та зважуванням, має значення при розрахунках закупки іонітів, тому що вартість останнього встановлюється за тонну матеріалу визначеної (стандартної) вологості. Чисельні значення вологості для катіонітів 35-60 %, аніонітів - 50-70 %. З врахування вологості та насипної маси можна розрахувати кількість сухого іоніту:
Вологість залежить від пористості іоніту:
5. Щільність іонітів – відношення маси речовини до об'єму [кг/м3] у залежності від іонної форми і природи складає 1,05-1,55 г/см3. Щільність аніонітів при цьому нижча, ніж у катіонітів, що лежить в основі гідравлічного поділу їхніх сумішей. Шляхом підбору іонітів підхожої щільності, декілька їхніх різноманітних типів можуть бути в однім фільтрі (ФЗД) і розділятися висхідним потоком води. Щільність набухшого іоніту завжди більше 1 і менше щільності сухого іоніту.
Щільність (істинна волога щільність гранул) важлива для розділення ФЗД, фільтрів з двошаровим завантаженням, ожиженим шарам, спушування. Вимірювання – пікнометричне.
6. Механічна тривкість - визначає можливість використання іонітів у конкретних умовах, терміни їхньої служби, і, отже, економічну ефективність. Механічна тривкість сприяє спроможність до опору при різноманітних деформаціях, тому що при експлуатації іоніти піддаються механічним навантаженням (здавлюванню, тертю); уникнути співудару зерен між собою, зі стінками фільтрів, їхнього відносного переміщення неможливо. Мірою механічної тривкості сипучих іонітів служать дані про зміну фракційного складу після експлуатації, що задається через коефіцієнт зтираємости, визначаємий як втрата маси в % за рік. Механічно тривкими прийнято вважати такі, відсоток зтираємости яких не перевищує 0,5 % за рік. Для швидкого аналізу - розмел у млині з і без сталевими або агатовими кулями. 7. Термічна стійкість У водних розчинах термічному руйнуванню підлягають полярні зв'язки функціональних груп – внаслідок чого втрачаються іонообмінні властивості. В процесі деградації аніонітів знижується основність: моно функціональний високоосновний стає поліфункцоінальним середньоосновним, потім – слабкоосновним. Реакції термічного розкладання
Катіоніти більше термостійкі ніж аніоніти, солеві форми більш стійкі ніж воднева та гідроксильна форми (різниця температур початку розкладання до 50 оС).
Вплив температури на іоніти
Для порошкоподібних (нерегенеруємих) іонітів – допускаються підвищені температури.
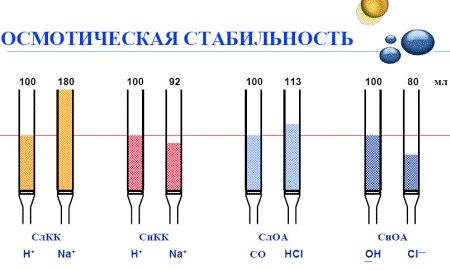
Іоніти характеризуються електризуємістю, тому що спроможні накопичувати заряди статичної електрики при терті, що ускладнює експлуатацію (злипання зерен, прилипання до стінок апаратів.) Для попередження електризуємості, іоніти оброблюють речовинами, що підвищують їхню електропровідність? Також відомо, що в абсолютно сухому стані іоніти мають високий електричний опір. При набряканні в полярних розчинниках шар набухшого іоніту стає достатньо електропровідним. У звичайних умовах електропровідність шарів цілком набухших у воді зерен іонітів коливається в межах 0,001-0,1 Ом-1*см-1, що використовується для електрохімічної регенерації. Основні хімічні властивості. 1. Хімічну стійкість промислових іонітів оцінюють насамперед по їхній розчинності у воді і розчинах, реагентах, які використовуються для регенерації і виражається в їх спроможності протистояти розчинюючій дії води та її домішок. Залежить стійкість від складу іоніту і його структури, рН середовища, кількості функціональних груп. Як правило іоніти більш схильні до пептизації (переходу в колоїдний розчин) при насиченні одновалентними іонами (H, Na, OH), а також при малій концентрації електролітів у воді, ніж при насиченні багатовалентними іонами (Ca, Mg, SO4) або в концентрованих розчинах солей. Окислювачі – кисень, хлор, озон, перекис водню руйнують іоніти, залізо та інші важкі метали в таких окислювальних процесах є каталізаторами. Внаслідок окислення сітка полімеру руйнується. Стійкість іонітів визначається індивідуально, але, як правило, і катіоніти і аніоніти більш стійкі в кислому середовищі, ніж у лужному. Вважається також, що полімеризаційні іоніти, особливо солеві форми, найбільш стійкі. Стійкість залежить і від температури, у зв'язку з чим не рекомендується підвищувати Т на і/обм. фільтрах більше 313 К (40 оС), тому що стійкість знижується при підвищенні Т. Нагрів іонітів призводить до зміни їхніх структури і хімічного складу, зводиться до відщіплення функціональних груп і руйнації полімерного каркасу. Солеві форми, як правило, більш стійкі, ніж Н и ОН (початок розкладання складає ~50 °С). Заморожування вологих іонітів у більшості випадків не призводить до помітної втрати обмінної ємності, але обумовлює їх механічну руйнацію (здрібнювання). 2. Осмотична стабільність (ОС) - один із найважливіших показників – характеризує здатність іоніту зберігати цілісність зерен внаслідок багатократного переходу з кислої (для катіонітів) або основної (для аніонітів) форми в солеву та навпаки. Поперемінне розтягування і стискання полімеру при наявності дефектів у його структурі супроводжується розривами ланцюгів у місцях max напруги. Мікроскопічні розриви згодом перетворюються в тріщини і, зрештою, призводять до самодовільного розтріскування зерен. Іншими словами, у процесі і/о конфігурація іонів навколо кожної активної групи змінюється, адсорбований (поглинений) іон, як правило, має інший розмір і інший рівень дегідратації, чим заміщаємий іон. Зерно іоніту, отже, може помітно набухати або стискатися в ході реакції. Стреси, до яких схильний іоніті в ході цих змін об'єму, відомі як осмотичні сили. Вони дуже інтенсивні і можуть робити локальні тиски в декілька тисяч кПа - набагато більше, ніж чисто механічний тиск. Іоніти для промислового використання повинні бути спроможні витримувати сотні циклів виснаження і регенерації. Стійкість до зміни змісту розчинника в різноманітних іонітів не однакова. Дослідження іонітів на ОС проводять або за ГОСТ, що передбачає проведення 150 циклів опрацювання порції іоніту розчинами кислоти і лугу з проміжними промиваннями дистильованою водою і наступне визначення кількості не зруйнованих гранул у % від загальної кількості зерен до та після обробки. Як правило, гелеві іоніти поступаються за ОС смолам макропористої і?зернистої структури. Для збільшення терміну служби іонітів необхідно уникати ситуацій, при яких можливі осмотичні удари (тобто швидке набухання). Значні руйнації спостерігаються у іонітів в сухому стані, які занурюють безпосередньо у воду (краще розчини 20-25 % NaCl); також не варто давати висихати іонітам, що відпускаються у вологому стані. Більшість сучасних іонітів повинні мати високу ОС - 95 % і вище. Вимоги АЕС по цьому показнику також високі, залежать від місця використання іонітів і регламентуються відповідними документами. Зменшення ОС спричиняє за собою такі негативні наслідки: - зменшення стійкості іонітів до зміни об'єму в експлуатаційних циклах; - зменшення терміну служби; - зростає перепад тиску на фільтрі через дрібні частки; - зменшується надійність експлуатації; - погіршується якість оброблюваної води; - зростаю експлуатаційні витрати.
3. Обмінна ємність (ОЄ) - також найважливіший показник для будь-якого іоніту, міра кількісної оцінки спроможності іоніту до реакцій подвійного обміну, що виражається числом еквівалентних іонів, обмінюванних 1 м3 іоніту. Так, наприклад, якщо ОЄ складає 500 г-екв/м3, то це означає, що 1 м3 такого іоніту обмінює 500 г-екв іонів, тобто може очистити від даного іону при його концентрації в розчині рівної 10 мг-екв/дм3 (10г-екв/м3) 50 м3 води, або при 5 мг-екв/дм3 - 100 м3 води тощо. · Розрахувати сумарну поверхню зерен іоніту, порівняти з розмірами та кількістю іонів в розчині Встановлюють різницю між загальною (повною) ємністю і корисною (робочою) ємністю. Повна обмінна ємність (ПОЄ) характеризує кількість в іонітах усіх іоногенних груп, незалежно від їхньої природи. Величина ПОЄ визначається за кількістю іоногенних груп в іоніті, є постійною характеристикою. Ще одне визначення ПОЄ - обмінна ємність, визначена в момент вирівнювання концентрації поглиненого іону у вихідній воді і фільтраті, відповідає max кількості іонів, вираженої в еквівалентних одиницях, що може сорбувати (обміняти) одиниця об'єму або маси іоніту. Фільтрування води через шар іоніту може, в залежності від умов і режиму експлуатації фільтру, продовжуватись до моменту одержання певної концентрації іона, що поглинається, у фільтраті. Якщо фільтрування закінчується тільки з'явиться проскок іону, що поглинається, тобто при концентрації його близької до О, то використовується ОЄ до проскоку. За величину проскоку звичайно приймають величину порядку 0,01-0,05 мг-екв/дм3. Проте в експлуатації фільтрування часто припиняється в момент, коли залишкова концентрація іону, що поглинається, у фільтраті значно більша ніж величина проскоку, або зупиняють фільтр при припиненні поглинання одних іонів і проскакування інших. У таких випадках мова йде про робочу обмінну ємність іоніту (РОЄ). Враховується тільки та частина протиіонів, що використовується в даних виробничих умовах. Для кожного іоніту РОЄ не однозначна, залежить від зміни робочих умов і розмірів фільтрувального шару, від концентрації іонів, що видаляються і середнього розміру часток, швидкості фільтрування, температури, засобу і ступеня регенерації. Лабораторна обмінна ємність, яка визначається за допомогою лабораторних фільтрів, звичайно більше експлуатаційної ємності поглинання, визначеної на великих промислових фільтрах, в яких гідравлічні умови роботи шару звичайно менш сприятливі. Значення ОЄ невизначене, якщо не зазначені умови, у яких вони визначалися (мг-екв на масу висушеного або об'єм сухого або набухлого іоніту). ПОЄ враховується для нового, РОЄ – для відрегенерованого іоніту. У залежності від технічного прийому здійснення визначення ОЄ розрізняють статичну (СОЄ) і динамічну (ДОЄ) обмінні ємності. Величина СОЄ характеризується кількістю протиіонів, що вступили в обмін до моменту рівноваги, коли іоніт і розчин, що контактує, нерухомі. Будь-яка зміна умов такого статичного процесу призводить до нового значення СОЄ. При динамічному пропусканні розчину через шар іоніту кількість протиіонів, що вступають у реакцію, визначає величину ДОЄ й істотне значення має потік води, що обумовлює поступовий зсув рівноваги як в іоніті, так і в розчині. Абсолютне значення ОЄ при будь-якому засобі її вираження багато в чому залежить від обраної методики її визначення. Тому в даний час вибір засобів ОЄ регламентується відповідним стандартом (ГОСТ 20255). Динамічною обмінною ємністю (ДОЄ) називають характеристику, подібну ПДОЄ, з тією лише різницею, що вимірюється не повна кількість іонів, поглинутих іонітом з розчину, а лише та, яка поглинута до першого проскоку поглинального іона у фільтрат. Цю характеристику іноді називають робочою обмінною місткістю (РОЄ). Графічне уявлення про ОЄ іоніту. При фільтруванні розчину через фільтр при достатній висоті завантаження іоніту, практично відразу ж спостерігається падіння концентрації іону, який поглинається, на виході у фільтраті практично до О (АВ). Потім протягом деякого проміжку часу (ВР) концентрація практично не змінюється. Починаючи з моменту, обумовленого т.С, відбувається проскок сорбуємого іону у фільтрат.
Графічне уявлення про ПОЄ та РОЄ Таким чином, можна констатувати, що геометрично SABCE, віднесена до одиниці об'єму іоніту відповідає проскоковій ОЄ. В міру пропускання нових порцій оброблюваної води, концентрація домішок у фільтраті буде збільшуватися і досягне значення, установленого регламентом експлуатації (т.Д). У виробничих умовах т..Д відповідає зупинці фільтру на регенерацію. Абсциса т.Д вказує об'єм очищеної води для даного технологічного циклу. SABCDF, віднесена до об'єму іоніту у фільтрі відповідає РОЄ. Якщо після досягання регламентованої концентрації домішки фільтр продовжує працювати, то в міру пропускання нових порцій розчину, концентрація сорбуємого іону буде зростати до повного вичерпання обмінних іонів іоніту і одержують ділянку кривої ДМ. Абсциса т.М відповідає загальному обсягу фільтрату, що пройшов очищення. Якщо далі пропускати через такий фільтр воду, то вона буде проходити його без змін в складі. SABCDMFE, віднесена до об'єму іоніту у фільтрі, відповідає ПОЄ іоніту. ПОЄ<ОЄпр>РОЄ. Н-д, ПОЄ для катіоніту :>3,9 мг-екв /г - суха смола, >1,2 мг-екв/см3 - волога смола. РОЄ для аніоніту може бути оцінена як 3 кг органіки в 1м3 смоли за 1 цикл. Вважається економічно оптимальними значення РОЄ=50-60 % ПОЄ. ПОЄ і РОЄ є головними показниками і/обм. властивостей іонітів і мірою універсальності, тобто спроможності до сорбції будь-яких іонів. Їх необхідно відрізняти від сорбційної спроможності (ємності) тобто їхньої спроможності до виборчої сорбції іона в конкретних рівноважних умовах із складного розчину. Перерахунок: Е' = 1000 * Е * r * (1-e) мг-екв/дм3 см3 в дм3 мг-екв/г г/см3 e-порозність Якщо концентрація різних іонів не однакова, то згідно ЗДМ поглинаються іони, які присутні в найбільшій концентрації, н-д, іони Са та Mg обмінюються на Na з концентрованих розчинів повареної солі. Корисна обмінна ємність залежить від наступних факторів: - якості іоніту - розміру зерен - природи оброблюваного розчину (вихідної води), наявності заліза, марганцю, органіки, значення рН, швидкості його потоку, температури - питомого навантаження - товщини шару іоніту, площі фільтрування - природи та концентрації регенераційного розчину - системи регенерації (прямоточна чи протиточна)
Порівняння сорбційної ємності мінералів по залізу та марганцю в статичних умовах та в „киплячому шарі”. Всі мінерали в статичних умовах проявляли свої сорбційні властивості менш активно до марганцю, ніж до заліза. При сорбції в ”киплячому шарі” спостерігалась зворотна залежність: ступінь вилучення по залізу менше ступеня вилучення по марганцю. Це можна пояснити тим, що іони марганцю легше осаджуються на оновлену поверхню „ефект „киплячого шару”), а іони заліза – на вже осаджену домішку заліза. Тому ємність по іонам заліза у всіх мінералів в статичних умовах вища, ніж по іонам марганцю. 4. Кислотно основні властивості іонітів. Насамперед пов'язують із дисоціацією Н-форми катіоніту (кислоти) і утворенням вільних катіонів Н+, а також із дисоціацією ОН-форми аніоніту (основи) і утворенню вільного іона гідроксилу ОН-. Основа таких уявлень - теорія кислот і основ Арреніуса і Бренстеда (дисоціація кислот на Н и аніон, основ - на ОН і катіон). Про силу кислот і основ судять по кривим, які характеризують зміну рН розчину кислоти (основи) при додаванні в нього основи (кислоти) - кривим титрування. Застосовують цю теорію до іонітів, тому що іоніт можна уподібнити кислоті або основі за здатністю до дисоціації. Поводження Н-форми катіоніту та ОН-форми аніоніту, подібно до кислот і основ кількісно характеризується константою дисоціації, найбільш поширеним засобом визначення якої є метод потенціометричного титрування. Криві потенціометричного титрування зернистих іонітів за формою нагадують криві титрування кислот і основ, але йдуть більш полого, а стрибки рН поблизу точки еквівалентності позначені менш чітко. Одержання кривих титрування твердих іонітів є складним (для сильнодисоційованих іонітів рівновага встановлюється через 1-2 год, для слабких – через тижні), тому про силу іонітів судять побічно по кривим титрування гетерогенної суміші - суспензії іоніту у воді кислотно-основні властивості іонітів, що відбивають, у неточному вигляді (для усунення цього дефекту в середовище, що титрується попередньо вводять нейтральні солі, наприклад (NaCl) або використовують достатньо здрібнений іоніт. Для сильнокислотних і сильноосновних іонітів поняття про ємність цілком визначене - вона залежить від природи і концентрації розчину, що насичує, у широкому інтервалі рН. На малюнку подані схематичні криві зміни обмінної ємності різноманітних типів катіонітв із зміною рН розчину. Крива 1 відноситься до монофункціонального сильнокислотного іоніту, показує сталість його обмінної ємності в широкому інтервалі значень рН. Іоніт у Н- формі в присутності NaCl титрують NaOH. При цьому протікає і/о: іоніт переходить із Н-форми в солеву форму: R-H+ + Na+-↔ R-Nа+ +H+ (1). Звільнені іони Н з'єднуються з іонами ОН- що добавляється з основою і ведуть реакцію до завершення, тобто утворенню води: Н+ + ОН-=Н2О (2). Тому рівновага обміну (1) зрушується вправо. Це означає, що додані іони Nа+ практично цілком поглинаються іонітом доти, поки останній містить іони Н+. У той же час значення рН водної фази майже не змінюється, тому що до насичення іоніту Na практично всі іони ОН нейтралізуються вільними іонами Н+..Як тільки іоніт віддасть усі іони Н+ (виснажиться), при подальшому додаванні основи, рН розчину різко зросте. Слабкокислотна смола (на рис. - крива 2) поводиться інакше, тому що її кислотні групи слабкодисоційовані, обмінна реакція (1) залишається незавершеною і рН розчину зростає прогресивно навіть на перших етапах титрування. Різке зростання можливо коли смола цілком переходить у Nа- форму. При дуже низьких значення рН обмінна ємність дорівнює практично 0; при підвищенні рН до деякого значення (яке залежить від Кд - т.А) обмінна ємність починає проявлятись та при збільшенні рН зростає. При доведенні рН до деякої величини (т.В), обмінна ємність досягає максимуму та більше не змінюється. Якщо катіоніт поліфункціональний (крива 3), то спостерігається послідовність у дисоціації його функціональних груп, аналогічна дисоціації двохосновних кислот. Як і для кислот, по витраті основи до стрибка рН можна обчислити максимальну ємність іоніту (вагову або об'ємну). Так, для 1 - вагова ємність = 5,3 мг- екв/г; для 2 - 9,7 мг-екв/г; для 3 - можна визначити як ємність сильних, так і слабких груп: відповідно 2 мг-екв/г і 5,5 мг-екв/г. Для низькоосновних і поліфункціональних аніонітів, вплив рН на зміну обмінної ємності прямо протилежний (підвищення обмінної ємності зі зниженням рН).
Потенціограми катіонітів (1 – сильнокислотний, 2- слабкокислотний, 3- середньокислотний) та аніонітів
Для кількісного опису цих кривих користуються напівемпіричними рівняннями: для катіонітів рКкат-рН=lg для аніонітів рКан-рОН=lg де рКкат, ан=-lgКкат, ан - називається константою дисоціації, що здається, яка деякою мірою (побічно) відбиває силу іоніту. α - ступінь іонізації функціональних груп (звичайно = 0,5, тобто 50% насичення слабкого іоніту іонами Na) Тому рівняння приймають вигляд: рКкат= -lg Ккат = рН рКАН=-lg Кан=14-рН=рОН. Ними можна користуватися для експериментальної оцінки КД функціональних груп Н і ОН - форм іонітів. Практично реалізується. Для сильноіонізованих іонітів характерна можливість 100% реалізації ПОЄ в будь-який іонній формі і при будь-якому складі оброблюваного розчину. Слабкоіонізовані іоніти не вступають у реакції обміну із солями кислот і основ, більш сильних, ніж іоніт (тобто ємність їх залежить від рН), що обумовлює межу їх придатності. Криві потенціометричного титрування дозволяють: 1) кількісно оцінити кислотно-основні властивості іонітів 2) характер функціональних груп 3) розрахувати їх обмінну ємність 4) оцінити і вибрати в першому наближенні оптимальне значення рН середовища при сорбції й оптимальній концентрації розчину кислоти або лугу при регенерації (ємність із зменшенням рН знижується, катіоніт не може сорбувати Ме, але може Н - можлива повна регенерація => регенерацію можна проводити при малих концентраціях). Про кислотно-основні властивості неорганічних катіонітів судити важко в зв'язку з нестійкістю їх Н-форм. 6. Набухання іонітів. Явища набухання тіл у воді відомі давно. Спостерігається в різноманітних проявах: вичинка шкіри, гончарне виробництво, ходьба по розмоклій дорозі та інш. Набуханням називається процес поступового збільшення об'єму твердого тіла, який розміщено в рідкий розчинник (воду), за рахунок проникнення води всередину тіла. Набухання може бути різноманітним в різних областях і характеризується ступенем (коефіцієнтом) набухання. Зворотній процес - усихання набухшого тіла. Для гелевих структур (іонітів) набухання є аналогічним розчиненню і викликається тими ж причинами (з точки зору термодинаміки причина набухання - в розходженні хімічного потенціалу розчинника в ненабухшому іоніті та в зовнішньому розчині, тобто розчинник з зовнішнього розчину з більш високою потенційною енергією намагатиметься перейти в іоніт). Отже, можна вважати, що набухше тіло це розчин, який складається з двох компонентів –твердого (матриці іоніту) і рідкого (води всередині іоніту). Набухання іонітів - входження полярного розчинника (води) у зерна іоніту, яке супроводжується розтягуванням полімерної матриці та обмежене наявністю ланок, що зшивають іоніт. Це - важлива властивість іонітів, що забезпечує швидке протікання іонного обміну і встановлення рівноваги; істотно впливає на кінетику і/обм. процесу. Обмін в набухших іонітах йде набагато швидше, ніж це можливо у твердих тілах та ненабухших іонітах.
Об'єм змінюється в зв'язку зі зміною гідратації активної групи: Зерна органічних молекул або продуктів конденсації нерозчинні у воді тому, що полімерні ланцюги макромолекул не тільки мають велику молекулярну масу, але ще поперечний зв'язані між собою, як би утворюючи просторову сітку потенційно пористої речовини. У іонітів звичайно немає пор у вигляді стабільних отворів і проходів певних мікроперетинів, як, наприклад у активованого вугілля, у зерен іонітів також немає стабільних геометричних розмірів. Вони здатні набухати у воді і декілька менше в інших органічних розчинниках. Проте безмежному набуханню, що граничить з розчиненням, перешкоджають поперечні зв'язки. Конкретних причин набухання дві: 1) наявність полярних функціональних груп, спроможних до гідратації, тобто до притягання в своє безпосереднє оточення молекул води (розчинника) і до утримання в іоніті протиіонів 2) наявність протиіонів, спроможних до гідратації і незалежного руху, до змішування з молекулами розчинника. Найбільш сильно набухають іоніти у воді. Для більшої частини іонітів характерне зростання об'єму при набуханні в 1,5 – 3,5 рази – це значний розбіг розмірів, і він повинен враховуватися при завантаженнях іонітів в іонообмінні фільтри. Набухання для попередження здрібнювання зерен рекомендовано проводити не у воді, а в розчині електроліту (н-д, NaCl) або при нагріванні. На набухання впливає: 1) заряд протиіонів в іоніті [(відповідно до т/д, у рівновазі з зовнішнім розчином іоніт з однозарядними іонами поглинає води більше, ніж іоніт із двохзарядними іонами (тому що в насиченому однозарядними протиіонами розчині їх в 2 рази більше, ніж у насиченому двохзарядними) і тому, що багатозарядні іони сильніше взаємодіють із функціональними групами, ніж однозарядні]. Серед одновалентних краще набухають ті, у яких радіус менше, тому що в них щільність заряду на поверхні вище і вони сильніше притягають диполі розчинника; Звичайно однозарядні іони, особливо водню і гидроксида, приводять до найбільшого набухання; багатозарядні протиіони приводять до деякого стиснення і зменшення об'єму зерен. 2) ступінь зшивки іоніту (чим сильніше зшитий, тим слабкіше його набухання, але тим більше зростає його механічна міцність); 3) концентрація і склад зовнішнього розчину (у більш концентрованих розчинах набухання значно слабкіше); 4) природа функціональних груп. Набухання сильноіонізованих Н-катіоніту та ОН-аніоніту максимально, а слабкоіонізованих - мінімально в порівнянні з відповідними солевими формами. 5)рН середовища. Катіоніти при зміні рН від нейтральної до кислої – стискаються, до лужної – набухають. Аніоніти – навпаки.
Якщо розглядають водяні розчини, то набухання називають гідратацією. Щоб уникнути порушення гідродинамічного та аеродинамічного режиму іонітового прошарку і поломок устаткування варто враховувати можливості різкої зміни його об'єму. У процесі гідратації або набухання іоніту, вільна енергія буде дорівнює різниці добутку концентрації іонів у фазі розчину і іоніту на відповідні хімічні потенціали:
Вираз для потенціалів має вигляд:
Тиск набухання позначають П і в якості його приймають такий міn тиск, який варто прикласти ззовні для того, щоб зерно іоніту, поглинаючи розчинник, не збільшувалося в обсязі. Продиференциювавши (3) по П при постійній температурі та після скорочення:
З хімічної т/д відомо
Підставляючи (3) в (4):
Після інтегрування і розділення перемінних одержуємо:
тобто тиск набухання визначається концентрацією іонів у фазі іоніту і можливої зміни його об'єму. Поглинання розчинника іонітом має місце в результаті проникнення молекул розчинника в простір між вуглеводними ланцюжками і молекулами зшивки. При цьому збільшенню обсягу зерен у певній мірі перешкоджають сили, що утримують воєдино каркас (матрицю) зерна іоніту. Таким чином, загальний тиск, що протидіє набуханню можна представити у вигляді:
де Ро - зовнішній тиск; Рзш - частина тиску набухання, сприйманого зчепленими вуглеводними ланцюгами і молекулами зшивки. (Також справедливо і таке вираження для тиску набухання П= Р-Р; Р- тиск, під яким знаходиться розчинник у фазі іоніту, Р- атмосферний тиск). В результаті підстановки (8) у (7), зміна об'єму при набуханні:
На практиці часто використовують емпіричний вираз для розрахунку зміни об'єму зерен іоніту при їх попаданні в розчинник:
де Vнаб, Vсух- об'єми сухого і набухлого іоніту, що припадають на 1 г-екв функціонально - активних груп; А - емпірична константа; Сзш – вміст речовини, що виступає в якості зшивки (найчастіше дивінілбензол). Питання про агрегатний стан набухлого іоніту. Фаза іоніту - своєрідний дволикий Янус, що сполучає властивості рідких і твердих тел. Класична т/д припускає існування таких фаз із складними властивостями, розглядаючи їх як тверді щодо одних своїх компонентів і рідкі щодо інших. Дослідження в
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 559; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.013 с.) |

 , об'єм
, об'єм 
 , г/см3
, г/см3 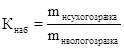
 см3/г
см3/г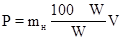 , г.
, г.

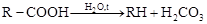




 (1)
(1) (2)
(2) (3)
(3) (4)
(4) (5)
(5)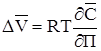 (6)
(6)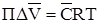 , звідки
, звідки  , (7)
, (7)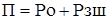 (8)
(8) (9)
(9)