
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакції і/о з врахуванням типу іонітуСодержание книги
Поиск на нашем сайте
Знаючи основні типи іонітів можна здійснити реакції і/о, що їм відповідають. Катіонний обмін використовується для видалення небажаних іонів із розчину в усьому діапазоні рН за допомогою сильнокислотних та слабкокислотних катіонітів. Смола може бути використана в різноманітних формах, але краща Na - тому що смола за структурою ближче до Na, що полегшує адсорбцію інших металів: Сильнокислотна смола в Н-формі: обмін катіонів з розчину на іон Н+ з іоніту з одержанням кислоти:
Ці реакції часто використовується на I етапі демінерализації. Слабкокислотна смола в Н-формі: карбоксильні смоли іонізують тільки в лужному середовищі. Вони мають високу близькість до 2-х валентних катіонів і в їхній присутності активні навіть у слабкокислому середовищі аж до рН=4,5, легко їх видаляють. Усуваються всі іони у воді, жорстко пов'язані з бікарбонатом: 2rcooh + NaHCo3 rcooNa+ h2o+C02↑ 2rcooh + Ca(HCo3)2 ® (rcoo)2Ca+ 2h2o+2C02↑
Н+ із карбоксильних смол не може видалити значних кількостей металів із розчинів мінеральних солей, тому що в результаті утворюється кислота, що швидко зменшує рН і перешкоджає подальшому і/о: 2rcooh + NaCl ® не йде В цьому випадку і/о контролюється аніонним складом розчину. У такий спосіб карбоксильні (слабкокислі) смоли переважно видаляють 2-х і 3-х валентні катіони, тобто вони певною мірою селективні саме до цих іонів: 2rcooh + Me(HCo3)2 ® (rcoo)2 Me + 2h2o+2C02↑
Аніонний обмін - використовується для видалення натуральних органічних кислот (і нітратів) із води за допомогою високосновних (сильноосновних) та слабкоосновних(низькоосновних) аніонітів. Високоосновна смола в ОН-формі - найбільше широко використовувана форма для аніонного обміну. Коли вона йде за водневим обміном у сильнокислій смолі, вона завершує процес демінералізації:
Низькоосновна смола в ОН-формі - активні групи - аміни, що не мають дійсної основної форми і іонізують тільки в кислому середовищі.
Низькоосновні аніоніти можуть адсорбувати тільки сильні кислоти, нейтральні солі не розщеплюють, немає реакції:
Обмін іонів у ФЗД Електродеіонізація – альтернатива ФЗД. У загальному випадку під іонітами в змішаному шарі розуміють механічну суміш іонообмінних смол, що містять протиіони різної хімічної природи. Якщо протиіони розрізняються по знаку заряду, змішаний шар буде сумішшю катіоніту і аніоніту. Такий змішаний шар є найхарактернішим і найчастіше вживається. Звичайно операції із змішаним шаром, що складається з катіоніту і аніоніту, здійснюють з іонними формами іонітів, які утворюють між собою малодисоційоване, легколетюче або важкорозчинне з'єднання. Механізм взаємодії між іонітами в змішаному шарі і розчинами електролітів складається з реакцій обміну іонів на окремі складові суміші і подальшої взаємодії між собою протиіонів, що перейшли в розчин. Змішаний шар іонітів іноді називають монобедом або монотанком. Розрізняють ФЗД з внутрішньою та виносною регенерацію. Суміші іонітів м.б. розділювані та не розділювані для проведення регенерації. Нерозділювані суміші. Швидкість осідання зерен:
Суміш катіоніту і аніоніту може бути одержана не тільки механічним перемішуванням окремих іонітів, але і хімічним синтезом. Подібна суміш на молекулярному рівні не розділяється звичними прийомами, які вживають для розділення механічної суміші. Вона зберігає здібність до одночасного поглинання, як катіонів, так і аніонів і знаходить застосування при очищенні неелектролітів від різних іонів за “способом відстаючого електроліту”. Певний інтерес представляє змішаний шар, складений тільки з катіоніту або аніоніту, протиіони яких мають однаковий знак заряду, але різко розрізняються по хімічних властивостях. Іоніти в подібному змішаному шарі можуть бути як ідентичними по структурі, природі матриці і характеру фіксованих іонів, так і різними. Для деяких робіт знаходить застосування змішаний шар, складений більш ніж з 2-х іонітів, наприклад з катіоніту і 2-х аніонітів або, навпаки, з 1-го аніоніту і 2-х катіонітів. У такій суміші 2 катіоніта (або 2 аніоніта) можуть розрізнятися як природою активних груп, тобто кислотністю або основністю, так і протиіонами. Отже, іоніти в змішаному шарі, як і в індивідуальному вигляді, використовуються як особливі хімічні реагенти, що володіють тією перевагою, що полімерна складова їх є нерозчинною. Тому застосування іонітів не ускладнює процес введенням в систему яких-небудь додаткових іонів, і кінцевий розчин можна легко відділити від іонітів шляхом фільтрування, центрифугування, декантацією і ін.
Переваги та недоліки ФЗД
При виборі конкретних іонних форм іонітів для здійснення окремого хімічного процесу із змішаним шаром звичайно враховують наступне. Для розчинів: 1. необхідність повного або виборчого видалення іонів; 2. яка чутливість розчину до змін pH середовища і можливість протікання при цьому побічних процесів; 3. чи впливає підвищення температури на стабільність окремих компонентів розчину; 4. наскільки швидко необхідно провести процес очищення; 5. які катіони і аніони знаходяться у вихідному розчині; Для іонітів: 1. чи забезпечують дані форми суміші іонітів необхідний ступінь очищення; 2. чи можлива зміна pH середовища при обміні іонів, і в якому напрямі; 3. чи можливе протікання побічних реакцій при безпосередньому зіткненні із зернами іонітів, що знаходяться в даних іонних формах; 4. чи стійкі ці форми іонітів в умовах проведення процесу (при підвищенні температури і ін.) і в даному розчині (окисляємость і т.д.); 5. чи забезпечують дані іонні форми іонітів необхідну швидкість процесу (враховуючи вплив на кінетику процесу зміни величини набухання іонітів при обміні іонів); 6. економічні чинники (вартість реагентів, що витрачаються на регенерацію, повнота використовування місткості і т.д.).
Представляє інтерес застосування таких форм суміші іонітів, які можуть утворювати в розчині з'єднання, аналогічне тому, що піддається очищенню – наприклад при очищенні води кращі Н- та ОН-форми. Присутність в початковому розчині домішок аніонів або катіонів, відповідні кислоти і основи яких важкорозчинні або нестійкі, обмежує можливості використовування для очищення цього розчину Н-катіоніту і ОН-аніоніту, оскільки випадання осаду створює деякі ускладнення при фільтруванні розчину через колонку.
Суміш іонітів може використовуватися для одночасного поглинання кислих, основних і нейтральних газів і пари, наприклад, аміаку і вуглекислого газу можна скористатися сумішшю катіоніту як в Н-формі, так і у формі важкого металу і аніоніту в ОН-ФОРМЕ: RH + NH3 = RNH4; R2Zn + 4NH3-=R2Zn (NH3)4; 2R/OH + СО2 = R2CO3 + Н2О; RH - R'OH + NH4C1 == RNH4 + R'Cl + Н2О Для проведення хімічного процесу з сумішшю двох іонітів принципово можливе використовування наступних їх поєднань в різних іонних формах: сильнокислотний катіоніт + сильноосновний аніоніт; сильнокислотний катіоніт + слабоосновний аніоніт; слабокислотний катіоніт + сильноосновний аніоніт; слабокислотний катіоніт + слабоосновний аніоніт; сильнокислотний катіоніт + сильнокислотний катіоніт; слабокислотний катіоніт + сильнокислотний катіоніт; слабокислотний катіоніт + слабокислотний катіоніт; сильноосновной аніоніт + сильноосновний аніоніт; слабоосновной аніоніт + сильноосновний аніоніт; слабоосновной аніоніт + слабоосновний аніоніт. Залежно від природи іоногенних груп катіоніти в Н-формі, а аніоніти в ОН-формі можуть проявляти властивості сильних або слабких кислот і основ. Відповідно в солевих формах слабокислотні катіоніти по властивостях подібні солям слабких кислот, а слабоосновні аніоніти — солям слабких основ. Так, Хейман і О'Доннел відзначають, що солеві форми слабокислотних або слабоосновних іонітів повільніше гідролізуються у воді, тоді як для іонітів з сильнокислотними або сильноосновними групами подібного явища практично не спостерігається. Іоніти з сульфогрупами (сильнокислотні) або з групами чверткових амонієвих основ (сильноосновні) є добре дисоційованими кислотами і основами, здібними до реакцій обміну іонів в широкій області рН. Для слабокислих катіонітів і слабоосновних аніонітів здібність до обміну іонів великою мірою визначається значенням рН розчину. Приклад: місткість поліфункціонального катіоніту IR-1 в 5 н. розчині NaCl збільшується від 1,8 мг-экв/г при рН 1 до 5,42 мг-экв/г при рН 8,8. Таку зміну величини місткості пов'язують з наявністю в іоніті трьох типів активних груп (— SO3H, — СООН і —<=>—ОН), які послідовно придбавають здібність до обміну іонів залежно від кислотності середовища: при рН<7 обмінюють іони —SO3H- і частково — СООН-групи, при рН> 7 —SO3H-, — СООН- і часткове —<=> N— ОН-групи, а при рН>7 в реакції обміну іонів беруть участь всі три типи груп. Подібно поводяться і аніоніти.
|
||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 247; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.43.92 (0.009 с.) |



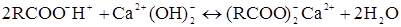
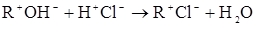
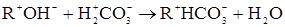

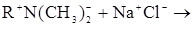 не йде
не йде .
.


