
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення сорбції та сорбційного процесу, умови проведенняСодержание книги
Поиск на нашем сайте Термін «сорбція» (від латин. Sorbeo - поглинаю) означає поглинання твердим тілом або рідиною речовини з навколишнього середовища. Біосорбція – активне вугілля дозовано вносять в аеротенк з активним мулом або в одношарових біосорберах. Сорбційний процес - самодовільний перерозподіл окремих компонентів між фазами, який йде без глибоких хімічних перетворень у двохфазних гетерогенних системах ГТ, ГР, РТ, РР (особливі властивості обох фаз). Розглядається як окремий випадок процесів перерозподілу з допоміжною активною фазою, внесену в рідину (або газ) для часткового або повного розділення компонентів. Внаслідок сорбційного процесу склад фаз змінюється - вони збагачуються одними й збіднюються іншими компонентами в певній мірі - звичайний випадок гетерогенного обміну та рівноваги. Оскільки ці компоненти розподілені в різній степені між фазами гетерогенної системи, то сорбційні процеси протікають в кожній фазі: в одній їх кількість збільшується, в іншій - зменшується. Н-д, на початку досліду є: дві фази (сорбент та розчин), які містять різні іони (розчин – іони виду i, сорбент – іони виду j). Знак заряду іонів повинен бути однаковим. При їх контакті починається взаємодія та взаємний перехід іонів, який продовжується до стану рівноваги: Перебіг і характер взаємодії фаз системи, а отже, характер і перебіг сорбційних процесів залежать від агрегатного стану фаз, властивостей і складу всіх компонентів, умов їхньої взаємодії, часу контакту. Часто одна з фаз практично не розчинна в іншій, компоненти ж останньої можуть поглинатися першою; також фізичний стан (суцільність, диспергованість) кожної фази м.б. різним (розчин – рідина, сорбент – шари з окремих часток). Наочно закономірності сорбційного процесу можна простежити в такому досліді: колонки заповнюють шарами сорбенту різної довжини (Х1, Х2, Х3), починають пропускати розчин з відомою концентрацією компоненту та виміряють час, на протязі якого сорбент буде повністю поглинати цей компонент (об'єм розчинів однаковий для всіх колонок). Відклавши по осі абсцис довжину шарів Хі (причому Х1<Х2<Х3), а по осі ординат час роботи шару сорбенту t (відповідно t1<t2<t3) - отримують графік. Зі збільшенням товщини шару сорбенту час роботи сорбенту збільшується. Нелінійна ділянка (ОА) на початку викликана неоднорідністю сорбенту, пов'язана з формуванням працюючої зони сорбенту, перед паралельним перенесенням речовини вздовж шару (ділянка АВ). V1=V2=V3
Протікання сорбційного процесу
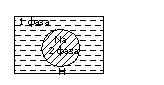
Якщо процес перерозподілу компонентів йде зі зменшенням кількості цільового компоненту в менш щільній фазі, то його називають сорбцією; в протилежному випадку процес називають десорбцією (регенерацією).
Схема сорбції-десорбції
Речовина, що сорбується, називається сорбатом (найчастіше це іони чи молекули з розчину). Сорбат повинен бути електролітом, тобто здатним розкладатись на іони. Частіше розглядаються процеси коли сорбат – розчин (природна вода, розчин електролітів). Фазу, що поглинає компоненти із сусідньої фази, тобто більш щільна речовина, що бере участь у процесі перерозподілу, називають сорбентом. Сорбенти - тверді, зернисті або волокнисті, механічно тривкі, нерозчинні та хімічно стійкі речовини, які використовують для видалення або розділення компонентів. Неодмінною властивістю сорбентів є їх спроможність утримувати на своїй поверхні або всередині різноманітні іони і при певних умовах обмінювати їх на інші іони з розчину, який контактує з сорбентом в сорбційному процесі (сульфовугілля, силікагель, іоніти). Найважливіші характеристики сорбентів: гранулометричний склад та сорбційна ємність. 1) сорбенти бувають різні за формою, невеликі за розмірами (найчастіше гранули* Ø до 5мм) *гранулами називають яскраві зерна 2) кількість іонів в сорбенті, які здатні до обміну, становить величину сорбційної або обмінної ємності (аналогія з концентрацією в розчині – визначається прямим титруванням. В сорбенті сорбційну ємність легше розраховувати за зміною концентрації розчину). Іони з сорбенту повинні проявитись – вступити в реакцію. Розрізняють поняття сорбційної ємності сорбенту (еквівалентна кількість компоненту, яку здатен поглинути певний об'єм сорбенту з розчину, н-д, мг-екв/мл) та сорбційної ємності шару сорбенту (мг-екв/мл*мл сорбенту=мг-екв). Вони відрізняються: перша величина визначається лише типом та природою сорбенту, а друга – умовами праці шару (швидкості пропускання розчину, його концентрацією тощо).
Сорбційну ємність розрізняють також з технологічної точки зору: 1) робоча або до проскоку - кількість компоненту, поглинутого сорбентом до появи певної, заданої кількості (проскоку) компоненту в фільтраті. Графічно відповідає площі ОАBD – визначається величиною проскоку, тобто ординатою точки В. Є величиною питомою, інтегральною, залежить від регенерації (1200 - 120 кг солі, 1400 – 140 кг). 2) повна або до виснаження – кількість цільового компоненту, поглинутого при повному виснаженні сорбенту, тобто при вирівнюванні концентрації компоненту у фільтраті з вихідною. Графічно – площа OABE – постійна величина для кожного сорбенту. Не залежить від концентрації та природи, тобто здатності до сорбції, будь-яких іонів.
Графічне представлення вихідної кривої
· Чому робоча ємність завжди нижча за повну? Робоча ємність залежить: - від загальної ємності; - кількості регенерату (чим більше, тим вище), особливо для сильноіонізованих; - швидкості потоку (особливо для слабкоіонізованих): високі швидкості знижують ємність; - склад вихідної води: юродство сорбенту до іонів різна); - температура: низька зменшує ємність, а значна не дає можливість видаляти кремнієву кислоту; - висота завантаження: велике завантаження збільшує ємність при протитоці
Сорбційні процеси класифікують за двома ознаками: механізмом взаємодії сорбату з сорбентом та методом здійснення сорбційного досліду. Механізм сорбції
Метод
Статичний Динамічний Хроматографічний
За механізмом сорбції (взаємодії сорбату з сорбентом) розрізняють такі процеси: 1. Адсорбція [ Абсорбція [ 2. Екстракція [ вилучення ] - розділення суміші за допомогою розчинника, в якому складові частини суміші неоднаково розчинні. М.б. газова чи рідка, н-д, вилучення U та Pu з палива чи руди. Здійснюється в промислових умовах в екстракторах або екстракційних колонах. 3. Іонний обмін - обратима хімічна реакція компонентів розчину електроліту з рухливими, обмінними катіонами або аніонами спеціального матеріалу – іоніту. Іноді називають обмінною адсорбцією – на відміну від адсорбції молекулярної без стехіометричного співвідношення між адсорбентом та сорбатом, на твердому іоніті відбувається адсорбція іонів з розчину в строго еквівалентних кількостях, обмін можна описати стехіометричними рівняннями. Здійснюється в промислових умовах в іонообмінних фільтрах. 4. Осадкоутворення - утворення компонентами розчину малорозчинних з'єднань з хімічно активними речовинами, які знаходяться в порах сорбенту. Здійснюється у відстійниках, освітлювачах, нейтралізаторах
В природі та технологічних сорбційних процесах взаємодія фаз гетерогенної системи може відбуватись як в умовах їх відносного спокою, так і при відносному русі. За методом розрізняють три способи здійснення сорбційного досліду: 1. статичний (вся маса сорбенту одночасно контактує з постійним обсягом розчину). Відносний спокій або безпорядочне нерегулярне перемішування для кращого контакту фаз. У випадку відносного спокою або безпорядочного перемішування сорбенту та розчину відбувається так звана статична сорбція, яка завершується встановленням сорбційної рівноваги. Основний параметр – час встановлення рівноваги, який залежить від сили електролітів (тобто здатності до дисоціації). Статична сорбція використовується при вивченні властивостей сорбенту, н-д, визначення ємності, побудові ізотерм сорбції, визначенні селективності сорбенту до різних компонентів з розчину. 2. динамічний (спрямоване відносне пересування фаз сорбенту і розчину) У випадку направленого відносного руху здійснюється динамічна сорбція, яка завершується за певним параметром – часом процесу сорбції або концентрацією сорбованого компоненту. Динамічна сорбція може реалізуватись за 4 напрямками: фільтруванням розчину через нерухомий шар, гідродинамічно зажатий шар, зважений шар[2], крізь шар сорбенту, який пересувається протиточно відносно розчину. 3. хроматографічний (в динамічних умовах за допомогою допоміжного розчину, що не містить компонентів вихідної суміші, досягається геометричне роз'єднанням компонентів суміші в шарі сорбенту та їх послідовний перехід в фільтрат). Хроматографія основана на фізичному явищі: різні гази (речовини) адсорбуються (поглинаються) активними речовинами з різною швидкістю. Тому, разом почавши шлях по хроматографічній колонці, заповненій такою речовиною, гази поступово розділяються, як бігуни “розтягуються” на довгій дистанції. Першими до протилежного кінця “добігають” ті гази, які погано адсорбуються активною речовиною, а останніми – ті, що адсорбуються краще всіх. Спеціальні детектори визначають вид та кількість газів. Механізм сорбції. Сорбційні процеси є основою ряду технологічних процесів: і/обм. очищення води (РТ), деаерація (ГР), декарбонізація (ГТ), рекарбонізація (РГ), винесення речовини з пари (ГТ), тощо. З численних варіантів апаратно-технологічного оформлення в умовах ЕС сорбційні процеси частіше реалізуються в умовах спрямованого переміщення фаз щодо одна одної (динамічне пропускання обробляємої рідкої суміші (розчину) крізь нерухомий шар твердої фази (сорбент).
Частка твердої фази, на якій відбулася адсорбція іонів з розчину 1) іони дифузійного шару біля поверхні 2) іони дифузійного шару всередині рідини
Для цих умов схематично механізм сорбції часток з розчину електроліту можна розглянути як адсорбцію окремих іонів, що відбувається на межі розподілу «розчин - поверхня твердої фази». Важливою та необхідною характеристикою є здатність обох фаз до дисоціації (тобто розкладання на іони). Просторово процес взаємодії починається з контакту двох фаз та молекулярної або хімічної взаємодії на межі поділу фаз. Атоми, молекули або іони, які знаходяться на межі, завдяки ненасиченості їх міжмолекулярних або хімічних зв'язків мають підвищену активність. При адсорбції іонів одного знаку, поверхня приймає заряд цих іонів, а розчин біля неї - протилежний за знаком внаслідок надлишку іонів, протилежних за знаком сорбованим іонам. Це створює різницю потенціалів між розчином і поверхнею і, як наслідок, обумовлює тяжіння поверхнею іонів протилежного знаку заряду з розчину. При цьому на іони, що знаходяться в розчині, діють такі сили: 1) сила електростатичного тяжіння з боку твердої фази, 2) дифузійні сили, під дією яких ці іони можуть рівномірно розподілятися по всьому об'ємі розчину. Дія цих сил призводить до утворення навколо твердої фази дифузійного шару іонів або іонної атмосфери, в якому концентрація іонів закономірно зменшується з віддаленням від поверхні твердої фази до меж розчину. Іони дифузійного шару, що мають запас кінетичної енергії, можуть вириватися з іонної атмосфери і переходити в розчин, з якого у свою чергу внаслідок дифузії можуть надходити іони того ж знаку заряду в еквівалентних кількостях (зберігання принципу електронейтральності). Процес взаємодії фаз гетерогенної системи закінчується встановленням певного рівноважного розподілення обмінних іонів між фазами. Висновок. З вищенаведеного, механізм процесу адсорбції можна характеризувати трьома складовими моментами: 1. виникнення заряду в твердій фазі внаслідок появи на ній потенціалутворюючих іонів. Потенціалутворюючі іони з'являються на поверхні внаслідок процесу дисоціації полярних молекул твердої фази, н-д, під дією води і кріпляться до так званої матриці сорбенту 2. утворення іонної атмосфери з протилежно заряджених іонів біля твердої фази 3. заміна іонів, які утворюють іонну атмосферу, іонами того ж знаку з розчину. Іони, сорбовані поверхнею (на мал. +) називають потенціалутворюючими (фіксованими або анкерними іонами); іони, що утворюють іонну атмосферу (на мал. -) називають іонами дифузійного шару. В зв'язку з тим, що іони дифузійного шару протилежні за знаком фіксованим іонам, їх зазвичай називають протиіонами (-); іони в розчині, однойменні з зарядом фіксованих іонів називають коіонами (+). В залежності від характеру появи потенціалутворюючих іонів на поверхні твердої фази, при внесенні її в розчин м.б. різний ефект. 1) Спочатку тверду фазу, яка здатна адсорбувати потенціалутворюючі іони (+) вносять в розчин з + та – іонами. Процес адсорбції потенціалутворюючих іонів R+H+=(RH)+. Позитивно заряджена тверда фаза з + іонами буде притягувати – іони дифузійного шару (RH)++Cl-=(RH+/Cl-). Як наслідок – зменшення концентрації Н та Cl в розчині – молекулярна адсорбція. При наявності в розчині інших аніонів внаслідок дифузії відбудеться заміна. 2) Якщо в розчин електроліту внести тверду фазу, яка дисоціює з віддачею іонів тільки одного знаку заряду, в перший момент буде спостерігатись утворення іонної атмосфери з цих дисоціюючих іонів. Внаслідок дифузії відбудеться заміщення іонів дифузійного шару іонами з розчину. Н-д, тверда фаза – важкорозчинна кислота і при внесенні її в розчин утворюється дифузійний шар іонів Н+. Якщо катіони в розчині Na, то вони замістять іони Н. У водопідготовці виключне застосування мають саме процеси заміщення іонів дифузійного шару твердої фази іонами з розчину – прийнято називати такий процес сорбцією (а не молекулярною адсорбцією). Для процесу сорбції іонів з розчину в сорбент можна виділити та практично спостерігати три стадії: 1) доставка витиснювальних іонів з розчину на поверхню сорбенту 2) проникнення витиснювальних іонів всередину сорбенту 3) хімічна взаємодія іонів розчину з іонами сорбенту. Іноді говорять про 4 та 5 стадії: 4) пересування витисняємого іону з середини від точки обміну до поверхні сорбенту 5) переміщення витісняємого іону від поверхні сорбенту в розчин. Всі стадії протікають послідовно, з різними швидкостями та одночасно в різних місцях сорбенту. Звертає увагу, що стадії 1 і 5, 2 і 4 є одно типовими (дифузійні), тобто передають різноманітне по напрямку, але не за характером пересування іонів, тому іноді обмежуються описом перших або останніх трьох стадій. 1-3 – робочий процес, 4-5 – регенерація.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 694; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.8.188 (0.01 с.) |






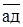 – на] - явище накопичення однієї речовини на поверхні іншої хімічно інертної внаслідок міжмолекулярної взаємодії - зовнішнє поглинання. Розрізняють молекулярну та іонну адсорбцію. АУ,СУ
– на] - явище накопичення однієї речовини на поверхні іншої хімічно інертної внаслідок міжмолекулярної взаємодії - зовнішнє поглинання. Розрізняють молекулярну та іонну адсорбцію. АУ,СУ - в] – це накопичення речовини всередині іншої речовини з утворенням змішаної фази (молекулярно-дисперсійне розподілення) - поглинання всередину (н-д, набухання).
- в] – це накопичення речовини всередині іншої речовини з утворенням змішаної фази (молекулярно-дисперсійне розподілення) - поглинання всередину (н-д, набухання).



