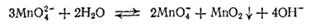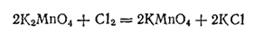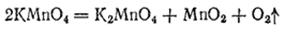Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соединения Марганца(VI) И (VII).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
При сплавлении диоксида марганца с карбонатом и нитратом калия получается зеленый сплав, растворяющийся в воде с образованием красивого зеленого раствора. Из этого раствора можно выделить темно-зеленые кристаллы манганита калия K2MnO4 - соли марганцовистой кислоты H2MnO4, очень нестойкой даже в растворе. Реакцию образования манганата калия можно выразить уравнением:
Если раствор манганата оставить стоять на воздухе, то окраска его постепенно изменяется, переходя из зеленой в малиновую, причем образуется темно-бурый осадок. Это объясняется тем, что в водном растворе манганаты самопроизвольно превращаются в соли марганцовой кислоты HMnO4 (перманганаты) с одновременным образованием диоксида марганца. Реакция выражается уравнением
или в ионно-молекулярной форме:
При этой реакции один ион MnO42- окисляет два других таких же иона в ионы MnO4-, а сам восстанавливается, образуя MnO2. Процесс превращения манганата в перманганат обратим. При действии сильных окислителей (например, хлора) на раствор манганата последний полностью превращается в перманганат:
Перманганат калия KMnO4 — наиболее широко применяемая соль марганцовой кислоты. Растворы KMnO4 имеют темно-малиновый, а при больших концентрациях — фиолетовый цвет, свойственный ионам MnO4-. Как и все соединения марганца (VII), перманганат калия — сильный окислитель.. Вступая в окислительно-восстановительные реакции, KMnO4 (ион MnO4-) может восстанавливаться в различной степени. В зависимости от pH среды продукт восстановления может представлять собою ион Mn2+ (в кислой среде), MnO2 (в нейтральной или в слабощелочной среде) или ион MnO4- (в сильнощелочной среде). Как энергичный окислитель перманганат калия широко применяют в химических лабораториях и производствах; он служит также прекрасным дезинфицирующим средством. При нагревании в сухом виде перманганат калия уже при температуре около 200°C разлагается согласно уравнению:
Этой реакцией иногда пользуются в лаборатории для получения кислорода. Соответствующая перманганатам свободная марганцовая кислота HMnO4 в безводном состоянии не получена и известна только в растворе. Это очень сильная кислота, в водном растворе полностью диссоциированная на ионы. Оксид марганца (VII), или марганцовый ангидрид, Mn2O7 может быть получен действием концентрированной серной кислоты на перманганат калия:
Применение. Более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей — кислорода, серы и других), а также для легирования сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами многих химических реакций, входят в состав микроудобрений. Биологическая роль. Марганец — микроэлемент, постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности. Марганец необходим животным и растениям для нормального роста и размножения. Он активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза, влияет на проветривание и минеральный обмен. В организме среднего человека (масса тела 70 кг) содержится 12 мг марганца. Человек с пищей получает ежедневно 0,4-10 мг марганца. Недостаток марганца в организме может привести к заболеванию человека. Для обеспечения нормального развития растений в почву вносят марганцевые микроудобрения (обычно в форме разбавленного раствора перманганата калия). Вопрос 19. Общая характеристика элементов VIIIВ группы. Железо. Химическая активность. Окислительно-восстановительные свойства. Железо как микроэлемент, гемоглобин. Применение железа в промышленности - стали, чугуны. Общая характеристика элементов VIIIВ группы: Свойства Fe,Co,Ni очень сходны между собой и сильно отличаются от своих соседних элементов по группам. Поэтому эти элементы объединяют в семейство железа, а тяжелые металлы 8 группы (Ru, Rh, Pd, Os, Ir, Pt) - в семейство платиновых металлов. Все элементы группы 8 содержат 8 электронов на своих валентных оболочках. Как и в других группах, члены 8 группы элементов проявляют закономерности электронной конфигурации, особенно внешних оболочек, хотя, как ни странно, рутений не следует этому тренду. Тем не менее, у элементов этой группы тоже проявляется сходство физических свойств и химического поведения. Атомы семейства железа не имеют свободного f-подуровня, в этом проявляются их отличительные свойства от элементов других триад. Металлы семейства железа обладают гораздо более высокой химической активностью по сравнению с семейством платиновых элементов. Железо Железо – химический элемент, атомный номер 26. Конфигурация двух внешних электронных слоев 3s23p23d64s2. Обычно образует соединения в степенях окисления +3 (валентность III) и +2 (валентность II). Известны также соединения с атомами железа в степенях окисления +4, +6 и некоторых других. Один из наиболее распростаненных элементов в природе. Особено важен для живых организмов: является основным катализатором дыхательных процессов. Железо входит в состав гемоглобина крови (477 мг/л), участвует в процессе переноса кислорода от легких к тканям. Железо встречается в природе в основном в виде руд. Основные руды железа: — магнетит (магнитный железняк) FезО4 (содержит до 72% железа В земной коре железо распространено достаточно широко - на его долю приходится около 5,1% массы земной коры. Физические свойства: Железо-блестящий серебристо-белый металл, его плотность 7,87 г/см3 , tпл=1359СО, tкип=3200СО, пластично, легко намагничивается и размагничивается. Химические свойства: Железо — активный металл. 1) На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. 3Fe + 2O2 = Fe2O3 • FeO (Феррит железа) 2) Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного оксида железа (III). 4Fe + 3О2 + 6Н2О = 4Fe(ОН)3 3) Взаимодействует с хлором, углеродом и другими неметаллами при нагревании: 2Fe + 3Cl2 = 2FeCl3 4) Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа: Fe + CuSO4 = FeSO4 + Cu 5) Растворяется в разбавленных серной и соляной кислотах c выделением водорода: Fe + 2Cl = FeCl2 + H2 Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная пленка пассивирует его поверхность. С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II): Fe + 2HCl = FeCl2 + H2 Fe + H2SO4 = FeSO4 + H2 При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа (III): 2Fe + 4H2SO4 = Fe2(SO4)3 + SO2 + 4H2O Соединения железа (III) в растворах восстанавливаются металлическим железом: Fe + 2FeCl3 = 3FeCl2 Окислительно-восстановительные свойства железа:
Железо в организме человека: Железо является очень важным микроэлементом. Железо в организме человека делится на клеточное и внеклеточное. Клеточное железо входит в состав различных классов металлоорганических соединений, обладающих характерной только для них функциональной активностью и биологической ролью для организма. Наиболее важные из них – гемоглобин и миоглобин. Общее содержание железа в организме человека составляет около 4,25 г. Средний пищевой рацион человека должен содержать не менее 20 мг железа. При недостатке его в пище резко нарушается синтез гемоглобина в крови. Железо в промышленности. 1) Чугун — железоуглеродистый сплав, в котором содержание углерода превышает 2%. В состав его также входят кремний, марганец, фосфор и сера. Чугун выплавляется в доменных печах из железных руд. Исходными материалами для его получения кроме руды служат топливо и флюсы. Производство чугуна Сырье: железная руда. Вспомогательные материалы: кокс (С), воздух, обогащенный кислородом, флюсы (СаCО3) Процессы, происходящие в доменной печи: С+О2= СО2; СО2+С = 2CO; Fe2O3+3CO = 2Fe+3СО2 Процесс непрерывный, но засыпка сырья (шихты) и выпуск чуryна производят периодически. Чугун с содержанием углерода 2.5%, включающее кроме этого примеси кремния, марганца, фосфора, серы. 2) Сталь — сплав железа с углеродом, содержащий углерода не более 2%. По сравнению с чугуном сталь обладает значительно более высокими физико-механическими свойствами. Она отличается высокой прочностью, хорошо обрабатывается резанием, ее можно ковать, прокатывать, закаливать. Она широко применяется во всех областях народного хозяйства, особенно в машиностроении. Производство стали Сырье: чугун. Вспомогательные материалы: воздух, обогащенный кислородом, добавки Кислородно-конверторный способ: окисление примесей в чугуне происходит в конверторе, воздух продувают через расплавленный чугун (нижнее дутье). Мартeновский способ: окисление примесей в чугуне происходит в мартеновской печи, нагретый воздух продувают над расплавленным чугуном (верхнее дутье). Сталь-железо с содержанием углерода <2%, может содержать специальные добавки.(Легированные стали). Вопрос 20. Алюминий. Характеристика алюминия на основании положения в Периодической системе элементов Д.И. Менделеева и строения атома. Получение, физические и химические свойства алюминия. Важнейшие соединения алюминия, их свойства, значение и применение. Природные соединения алюминия. Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства промежуточного характера и его соединения являются амфотерными. (p – элемент) Физические свойства Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650оС. Алюминий имеет невысокую плотность (2,7 г/см3) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл. В природе алюминий встречается только в соединениях (минералах). Некоторые из них: · Бокситы — Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3) · Нефелины — KNa3[AlSiO4]4 · Алуниты — KAl(SO4)2 • 2Al(OH)3 · Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3) · Корунд — Al2O3 Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы). Получение алюминия 1) Электролиз: 2Al2O3 эл.ток→ 4Al + 3O2 2) Восстановление металла из оксида: 2Al2O3 + 3C = 4Al + 3CO2
|
||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 922; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.250.221 (0.009 с.) |