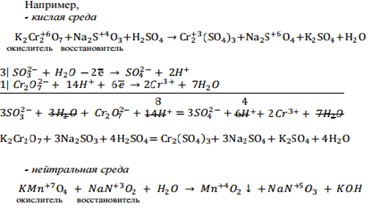Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронное строение атомов элементов первых четырех периодов таблицы Д.И. МенделееваСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вопрос 1. Строение электронной оболочки атома. Электронное строение атомов элементов первых четырех периодов таблицы Д.И. Менделеева. Расчет количества протонов, нейтронов и электронов в атоме. Квантовые числа, типы электронных орбиталей, правило Хунда, принцип Паули, правила Клечковского. Сердце атома — это его ядро. Вокруг него располагаются электроны. В начале XX в. была принята планетарная модель строения атома, согласно которой вокруг очень малого по размерам положительного ядра движутся электроны. Электроны, двигаясь вокруг ядра атома, образуют в совокупности его электронную оболочку. Чем ближе электроны к ядру, тем они прочнее связаны с ним, и их труднее вырвать из электронной оболочки, а вот чем дальше они от ядер, тем легче их оторвать. Очевидно, что по мере удаления от ядра атома запас энергии электрона увеличивается. Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями. Число энергетических уровней равно номеру периода в таблице Д. И. Менделеева, в котором находится химический элемент. Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп. Свойства химических элементов периодически повторяются, так как периодически повторяется строение внешних энергетических уровней у их атомов. Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле: N = 2n2 Электронное строение атомов элементов первых четырех периодов таблицы Д.И. Менделеева Элементы I периода: Водород и гелий — s-элементы; у этих атомов заполняется электронами s-орбиталь. Элементы II периода: У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют s- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s, а затем р) и правилами Паули и Хунда. Элементы III периода: У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-подуровни. Элементы IV периода: Это d-элементы. Электронами заполняется d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп. Их также называют переходными элементами. Число протонов = порядковому номеру элемента в таблице Д. И. Менделеева. Число нейтронов = атомная масса элемента – порядковый номер элемента Число электронов = числу протонов в ядре атома и определяется порядковым или атомным номером элемента в таблице. Квантовый числа: 1) Главное квантовое число (n = периоду) 2) Орбитальное (L). Зависит от формы орбитали 3) Магнитное (-L ≤ m ≤ L) 4) Спиновое (s). Только два значения +1/2 или -1/2 (зависит от движения) Типы электронных орбиталей. 1) s -орбиталь -сферическая атомная орбиталь. Она самая устойчивая и располагается довольно близко к ядру. 2) Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания и превращается в p -орбиталь: Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. 3) d -орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре. 4) Электронных облаков с одинаковой энергией, которым присвоено имя f -орбиталей, может быть уже семь. Они тоже различны по форме и по-разному ориентированы в пространстве. Правило Хунда: наиболее устойчивое состояние атома является такое, при котором в пределах одного подуровня атом обладает максимально возможным числом неспаренных электронов. Такое наиболее устойчивое состояние атома называется основным состоянием. Принцип Паули: на каждой орбитали может находиться не более двух электронов. Если на орбитали находится один электрон, то он называется неспаренным, а если два, то их называют электронной парой. Правила Клечковского: 1) Заполнение орбиталей происходит от орбиталей с меньшим значением суммы главного квантового числа и орбитального числа (n+l) к орбиталям с большим значением этой суммы 2) При одинаковых значениях суммы n+l заполнение происходит в направлении возрастания главного квантового числа Вопрос 2. Вопрос 3. Гибридизация орбиталей Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
Типы химических связей. 1) Ионная (металл + неметалл) 2) Ковалентная (неметалл + неметалл с помощью общих электронных пар) Обменный механизм - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. Каждый из атомов предоставляет в общее пользование по одному электрону: Донорно-акцепторный механизм (координационная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). 3) Металлическая (между атомами металлов, между ионами металлов и общими свободными электронами) 4) Водородная (между водородом одной молекулы и другим более электроотрицательным элементом (O, S, N, F) и с другой молекулой) Потенциал ионизации атома - минимальная разность потенциалов U, которую должен пройти электрон в ускоряющем электрическом поле, чтобы приобрести кинетическую энергию, достаточную для ионизации атома. Электроотрицательность (ЭО) – относительная способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей. Вопрос 4. Вопрос 5. Классификация неорганических соединений (кислоты, основания, соли, оксиды). Привести примеры, дать названия. Эквивалент вещества. Исходя их состава молекул, вещества делятся на простые и сложные. Простые вещества – вещества, молекулы которых состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Простые вещества разбиваются на две большие группы: металлы и неметаллы. Металлы – группа элементов, обладающая характерными металлическими свойствами: твёрдые вещества (исключение-ртуть) имеют металлический блеск, являются хорошими проводниками теплоты и электричества, ковкие (железо (Fe), медь (Cu), алюминий (Al), ртуть (Hg), золото (Au), серебро (Ag) и др.). Неметаллы – группа элементов: твёрдые, жидкие (бром) и газообразные веществ, которые не обладают металлическим блеском, являются изоляторы, хрупкие. Сложные вещества (или химические соединения) – вещества, молекулы которых состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ. Сложные вещества подразделяются на четыре группы, или класса: оксиды, основания, кислоты и соли. Оксид - сложное вещество, состоящее из атомов двух элементов, один из которых – кислород в степени окисления -2. Бывают солеобразующие: основные (Na2O, CaO), кислотные (CO2, SO3), амфотерные (Al2O3, ZnO) и несолеобразующие (СО, N2O) Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами. Выделяют растворимые (щелочи) и нерастворимые основания. Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток. Классификация кислот по составу- кислородсодержащие(H2SO4, HNO3) и бескислородные (H2S, HCl) Соли – это сложные вещества, молекулы которых состоят из атомов металлов и кислотных остатков. Соль представляет собой продукт частичного или полного замещения атомов водорода кислоты металлом. Соли делят на средние (Na2SO4, K3PO4), кислые (NaHCO3), основные ((CuOH)2CO3) Эквивалентом называют реальную или условную частицу вещества, которая взаимодействует с одним атомом или ионом водорода в обменных реакциях или соответствует одному электрону в окислительно – восстановительных реакциях. Вопрос 6. Получение 1. Взаимодействие активного металла с водой: 2Na + 2H2O → 2NaOH + H2 Ca + 2H2O → Ca(OH)2 + H2 Mg + 2H2O→ Mg(OH)2 + H2 2. Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов): Na2O + H2O → 2NaOH, CaO + H2O → Ca(OH)2 3. Промышленным способом получения щелочей является электролиз растворов солей: 2NaCI + 4H2O= 2NaOH + 2H2 + CI2 4. Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения: Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4 MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4. Физические свойства Все основания являются твердыми веществами. В воде нерастворимы, кроме щелочей. Щелочи – это белые кристаллические вещества, мылкие на ощупь, вызывающие сильные ожоги при попадании на кожу. Химические свойства Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид –ионов ОН—. 1. Изменение цвета индикаторов: фенолфталеин – малиновый лакмус – синий метиловый оранжевый – желтый 2. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации): 2NaOH + H2SO4 → Na2SO4 + 2H2O, Cu(OH)2+ 2HCI → CuCI2 + 2H2O 3. Взаимодействие с кислотными оксидами: 2NaOH + SO3 → Na2SO4 + H2O 4. Взаимодействие с амфотерными оксидами и гидроксидами: а) при плавлении: 2NaOH + Al2O3=2NaAIO2 + H2O NaOH + AI(OH)3=NaAIO2 + 2H2O. б) в растворе: 2NaOH + AI2O3 +3H2O → 2Na[AI(OH)4], NaOH + AI(OH)3 → Na[AI(OH)4]. 5. Взаимодействие с растворимыми солями с образованием осадков: 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4, Ba(OH)2 + K2SO4 → BaSO4+2KOH. 6. Малорастворимые и нерастворимые основания разлагаются при нагревании: Ca(OH)2 =CaO + H2O, Cu(OH)2= CuO + H2O. Амфотерные гидроксиды Это гидроксиды металлов (Be(OH)2, AI(OH)3, Zn(OH)2) и металлов в промежуточной степени окисления (Сr(OH)3, Mn(OH)4). Получение Амфотерные гидроксиды получают взаимодействием растворимых солей со щелочами взятых в недостатке или эквивалентном количестве, т.к. в избытке они растворяются: AICI3 + 3NaOH → AI(OH)3 +3NaCI. Химические свойства Амфотерные гидроксиды проявляют свойства оснований и кислот, поэтому взаимодействуют как с кислотами, так и с основаниями. 1. Взаимодействие с кислотами с образованием соли и воды: Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O. 2. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды: AI(OH)3 + NaOH =[AI(OH)4], AI(OH)3 + NaOH=NaAIO2 + 2H2O Вопрос 7. Получение кислот 1. Бескислородные кислоты могут быть получены при непосредственном соединении неметаллов с водородом: H2 + Cl2 → 2HCl, H2 + S 2. Кислородсодержащие кислоты нередко могут быть получены при непосредственном соединении кислотных оксидов с водой: SO3 + H2O = H2SO4, CO2 + H2O = H2CO3, P2O5 + H2O = 2HPO3. 3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами: BaBr2 + H2SO4 = BaSO4 + 2HBr, CuSO4 + H2S = H2SO4 + CuS, CaCO3 + 2HBr = CaBr2 + CO2↑ + H2O. 4. В ряде случаев для получения кислот могут быть использованы окислительно-восстановительные реакции: H2O2 + SO2 = H2SO4, 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑. Химические свойства кислот 1. Наиболее характерное химическое свойство кислот – их способность реагировать с основаниями (а также с основными и амфотерными оксидами) с образованием солей, например: H2SO4 + 2NaOH = Na2SO4 + 2H2O, 2HNO3 + FeO = Fe(NO3)2 + H2O, 2HCl + ZnO = ZnCl2 + H2O. 2. Способность взаимодействовать с некоторыми металлами, стоящими в ряду напряжения до водорода, с выделением водорода: Zn + 2HCl = ZnCl2 + H2↑, 2Al + 6HCl = 2AlCl3 + 3H2↑. 3. С солями, если образуется малорастворимая соль или летучее вещество: H2SO4 + BaCl2 = BaSO4↓ + 2HCl, 2HCl + Na2CO3 = 2NaCl + H2O + CO2↑, 2KHCO3 + H2SO4 = K2SO4 +2SO2↑ + 2H2O. Заметим, что многоосновные кислоты диссоциируют ступенчато, причем легкость диссоциации по каждой из ступеней падает, поэтому для многоосновных кислот вместо средних солей часто образуются кислые (в случае избытка реагирующей кислоты): Na2S + H3PO4 = Na2HPO4 + H2S↑, NaOH + H3PO4 = NaH2PO4 + H2O. 4. Частным случаем кислотно-основного взаимодействия являются реакции кислот с индикаторами, приводящие к изменению окраски, что издавна используется для качественного обнаружения кислот в растворах. Так, лакмус изменяет цвет в кислой среде на красный. 5. При нагревании кислородсодержащие кислоты разлагаются на оксид и воду (лучше в присутствии водоотнимающего P2O5): H2SO4 = H2O + SO3, H2SiO3 = H2O + SiO2. Вопрос 8. Химические свойства солей При химических реакциях солей проявляются особенности как катионов, так и анионов, входящих в их состав. Катионы металлов, находящиеся в растворах, могут вступать в реакции с другими анионами с образованием нерастворимых соединений. С другой стороны, анионы, входящие в состав солей, могут соединяться с катионами с образованием осадков или малодиссоциированных соединений (или же в окислительно-восстановительные реакции). Таким образом, соли могут реагировать: 1. С металлами Cu + HgCl2 = CuCl2 + Hg, Zn + Pb(NO3)2 = Zn(NO3)2 + Pb. 2. C кислотами Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑, AgCl + HBr = AgBr↓ + HCl 3. C солями AgNO3 + NaCl = AgCl↓ + NaNO3, K2CrO4 + Pb(NO3)2 = KNO3 + PbCrO4↓. 4. C основаниями CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4, Ni(NO3)2 + 2KOH = Ni(OH)2 + 2KNO3. 5. Многие соли устойчивы при нагревании. Однако, соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются: CaCO3 = CaO + CO2, NH4Cl = NH3 + HCl. Вопрос 9. Основные оксиды Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Основным оксидам соответствуют основания. Например, оксиду кальция CaO отвечает гидроксид кальция Ca(OH)2. Получение 1. Непосредственное взаимодействие металла с кислородом: 2Mg + O2 = 2MgO. 2. Горение сложных веществ: 2FeS + 3O2 = 2FeO + 2SO2. 3. Разложение солей кислородсодержащих кислот: CaCO3 = CaO + CO2. 4. Разложение оснований: Ca(OH)2 = CaO + H2O. Физические свойства. Все основные оксиды – твердые вещества, чаще нерастворимые в воде, окрашенные в различные цвета, например Cu2O –красного цвета, MgO – белого. Химические свойства 1. Основные оксиды взаимодействуют с водой с образованием оснований. Непосредственно в реакцию соединения с водой вступают только оксиды щелочных и щелочноземельных металлов: Na2O + H2O → 2NaOH, CaO + H2O → Ca(OH) 2. 2. Взаимодействие с кислотами с образованием соли и воды: CaO + H2SO4 → CaSO4 + H2O. 3. Взаимодействие с кислотными оксидами с образованием соли: СaO + SiO2 → CaSiO3 4. Взаимодействие с амфотерными оксидами: СaO + Al2O3 → Сa (AlO2) 2. Кислотные оксиды Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Им соответствуют кислоты. Например, оксиду серы (IV) соответствует сернистая кислота H2SO3. Получение 1. Горение сложных веществ: CH4 + 2O2 → CO2 + 2H2O. 2. Разложение кислородосодержащих кислот: H2SO4 → SO3 + H2O. 3. Взаимодействие неметалла с кислородом: S + O2 → SO2. 4. Разложение солей кислородсодержащих кислот: CaCO3 → CaO + CO2. Физические свойства. Кислотные оксиды могут быть твердыми, жидкими и газообразными: Р2О5 – твердый, SiO2 – твердый, СО2 – газообразный,. SO3 – жидкий. К воде относятся по-разному (Р2О5 – растворимый, SiO2 – нерастворимый). Химические свойства 1. Взаимодействие с водой с образованием кислоты: P2O5 + 3H2O → 2H3PO4. 2. Взаимодействие со щелочами с образованием соли и воды: SO3 + 2NaOH → Na2SO4 + H2O. 3. Взаимодействие с основными оксидами с образованием солей: SO3 + Na2O → Na2SO4. Амфотерные оксиды Оксиды, гидратные соединения которых проявляют свойства как кислот, так и оснований, называются амфотерными. Например: оксид алюминия Al2O3, оксид марганца (IV) MnO2. Получение. Способы получения амфотерных оксидов аналогичны основным оксидам. Физические свойства. Поскольку это оксиды металлов, то они, как и основные оксиды, твердые вещества, мало или нерастворимые в воде. (Al2O3 – нерастворим в Н2О). Некоторые из них имеют характерную окраску (Fe2О3– бурый). Химические свойства 1. C водой не взаимодействуют. 2. Взаимодействие с кислотными оксидами с образованием солей при сплавлении (основные свойства): ZnO + SiO2 → ZnSiO3. 3. Взаимодействие с кислотами с образованием соли и воды (основные свойства): ZnO + H2SO4 → ZnSO4 + H2O. 4. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды (кислотные свойства): Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4], AI2O3 + 2NaOH→2NaAIO2 + H2O. 5. Взаимодействие с основными оксидами (кислотные свойства): AI2O3 + CaO →Ca(AIO2)2. Вопрос 10. Виды коррозии. В зависимости от механизма процесса разрушения металла коррозия может быть химической и электрохимической. Химическая коррозия возникает при действии на металл сухих газов или жидкостей органического происхождения, которые не являются электролитами. Примером химической коррозии служит окисление металла при высоких температурах, в результате чего на его поверхности возникает продукт окисления – окалина. Данный вид коррозии встречается редко. Электрохимическая коррозия образуется в результате воздействия на металл электролитов (растворов кислот, щелочей и солей В зависимости от характера окружающей среды электрохимическая коррозия может быть: атмосферной, подводной, почвенной, вызванной блуждающими токами. Существуют различные методы защиты металлов от коррозии: Лакокрасочные покрытия – наиболее распространенный вид антикоррозионной защиты металла. В качестве пленкообразующих материалов используют нитроэмали, нефтяные, каменноугольные и синтетические лаки, краски на основе растительных масел и др. Образующаяся при покрытии на поверхностях конструкций плотная пленка изолирует металл от воздействия окружающей его влажной среды. Неметаллические покрытия довольно разнообразны. К ним относят эмалирование, покрытие стеклом, цементно-казеиновым составом, листовым пластиком и плитками, напыление пластмасс. Металлические покрытия наносят на металлы гальваническим, химическим, горячим, металлизацией и другими способами. При гальваническом способе защиты на поверхности металла путем электролитического осаждения из раствора солей металлов создается тонкий защитный слой какого-либо металла. Химическая обработка поверхности металла – изделия погружают в ванну с расплавленным защитным металлом. Металлизация – распространенный способ защиты металлов в строительстве. Он состоит в нанесении сжатым воздухом тончайшего слоя распыленного расплавленного металла. При защите легированием в металл вводят легирующие элементы, повышающие сопротивление сплава коррозии. Защита от огня. Для защиты металлоконструкций наиболее перспективны вспучивающиеся покрытия или краски на основе полимерных связующих, которые при воздействии огня образуют закоксовавшийся вспененный расплав, препят-ствующий нагреву металла. Для повышения предела огнестойкости (600 °С) металлических, в том числе алюминиевых, конструкций применяют также асбестоцементные, асбестоперлитовые, асбестовермикулитовые покрытия, наносимые пневмонапылением. Новый вид огнезащиты – фосфатное покрытие толщиной 20-30 мм, представляющее собой стойкую (при 1000 °С) монолитную легкую массу. Традиционные способы увеличения предела огнестойкости, использование облицовок и штукатурок из несгораемых огнезащитных материалов (кирпича, пустотелой керамики, гипсовых плит, растворов и др.). Вопрос 11. Типы химических реакций. Окислительно-восстановительные реакции: реакции межмолекулярного, внутримолекулярного окисления-восстановления, реакции самоокисления самовосстановления. Методы электронного и электронно-ионного баланса. ТИПЫ КЛАССИФИКАЦИИ РЕАКЦИИ:
По тепловому эффекту:
По присутствию других веществ:
Окислительно-восстановительными называют реакции, происходящие с изменением степеней окисления элементов, входящих в состав взаимодействующих веществ. Степенью окисления атома в молекуле называют условный заряд, возникающий при смещении электронной пары к более электроотрицательному атому. Степень окисления подсчитывают, исходя из того, что сумма степеней окисления всех атомов в молекуле вещества равна нулю. Окислитель присоединяет электроны и при этом восстанавливается (понижает свою степень окисления). Вещества, в состав которых входят элементы с максимальной степенью окисления, всегда являются окислителями. Восстановитель отдает электроны и при этом окисляется (повышает свою степень окисления). Вещества, содержащие элементы с минимальной степенью окисления всегда являются восстановителями. Таким образом, в окислительно-восстановительных реакциях происходит следующий процесс: окислитель(I) + восстановитель(II) ⇆ восстановитель(I) + окислитель(II) Если в состав вещества входят элементы с промежуточной степенью окисления, то такие вещества могут проявлять как окислительные, так и восстановительные свойства. Для составления уравнений окислительно-восстановительных реакций нужно знать окислительно-восстановительные свойства исходных веществ, на основании которых устанавливают состав продуктов реакции. Если известна схема реакции (исходные вещества и продукты), то остается расставить стехиометрические коэффициенты. Для этой цели применяют методы электронного баланса и ионно-электронный. Для реакций, протекающих в растворах, чаще всего используют ионно-электронный метод, сущность которого заключается в том, что для составления полуреакций процессов окисления и восстановления берут реально существующие в растворе ионы. Для составления реакций окисления-восстановления следует: 1. Учитывать, в какой среде протекает окислительно- восстановительная реакция. 2. Написать уравнение реакции в молекулярной и ионной форме. 3. Выбрать ионы или молекулы, в которых элементы меняют степень окисления, т.е. выбрать окислитель и восстановитель. 4. Уравнять количество элементов в правовой и левой частях (в кислой среде при наличие кислорода он уравнивается молекулой воды, в щелочной кислород уравнивается удвоенным количеством гидроксильных групп, в нейтральной среде – слева только вода). 5. Уравнять количество зарядов в правой и левой частях путем добавления или отнятия электронов. 6.Уравнять число электронов, отданных восстановителем и принятых окислителем. 7. Сложить уравнения полуреакций с учетом найденных коэффициентов. Сократить одноименные ионы и молекулы, встречающиеся в обеих частях уравнения. 8. Расставить коэффициенты в уравнении реакции.
Вопрос 12. Сила кислот и оснований Направление смещения кислотно-основного равновесия определятся следующим правилом: Кислотно-основные равновесия смещены в сторону более слабой кислоты и более слабого основания. 1) Сила кислоты – характеристика кислоты, показывающая, насколько легко кислота отдает протоны молекулам данного растворителя. Кислота тем сильнее, чем легче она отдает протон, а основание тем сильнее, чем легче оно принимает протон и прочнее его удерживает. Молекула (или ион) слабой кислоты не склонна отдавать протон, а молекула (или ион) слабого основания не склонна его принимать, этим и объясняется смещение равновесия в их сторону. Так как кислоты могут реагировать с разными основаниями, то соответствующие равновесия будут смещены в ту или иную сторону в разной степени. Сильная кислота – кислота, реагирующая с избытком воды необратимо. Слабая кислота – кислота, реагирующая с избытком воды обратимо и, как правило, незначительно. Сильные кислоты: HCl, HBr, HI, HClO4, HClO3, H2SO4, H2SeO4, HNO3 и некоторые другие. 2) Сила основания – характеристика основания, показывающая, насколько прочно основание связывает протоны, оторванные от молекул данного растворителя. Основание тем сильнее, чем слабее сопряженная кислота. И наоборот, кислота тем сильнее, чем слабее сопряженное основание. Как и кислоты, существуют сильные и слабые основания. Сильное основание – основание, реагирующее с избытком воды необратимо. Слабое основание – основание, реагирующее с избытком воды обратимо и, как правило, незначительно. К сильным веществам-основаниям относятся все хорошо растворимые ионные гидроксиды (их называют еще " щелочами "), так как при их растворении в воде гидроксид-ионы полностью переходят в раствор. К слабым основаниям относится практически нерастворимые гидроксиды элементов, образующих металлы. Не обладают основными свойствами анионы Cl, Br, I, HSO4, NO3 и другие анионы, образующиеся из сильных кислот Не обладают кислотными свойствами катионы Li, Na, K, Ca2, Ba2 и другие катионы, входящие в состав сильных оснований. Вопрос 13. Вопрос 14. Константа гидролиза По величине константы гидролиза можно судить о полноте гидролиза: чем больше ее значение, тем в большей мере протекает гидролиз. Константа и степень гидролиза связаны соотношением: Kг = С· h 2/(1- h), моль/л Где С – концентрация соли в растворе, h- степень гидролиза Это выражение можно упростить, т.к. обычно h˂˂1, тогда Kг = С· h 2 Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением: Kг = KH2O/Kосн Сравнивая величины Kг и Kосн можно качественно определить pH среды. Так, если Kг намного больше Kосн, то среда сильнокислая, при Kг намного меньшей Kосн — среда слабокислая, а если Kг и Kосн сопоставимы, то — среднекислая. Для солей, образованных сильным основанием и слабой кислотой, константа гидролиза и константа диссоциации кислоты связаны зависимостью Kг = KH2O/Kк-ты Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота. Вопрос 15. Дисперсные системы. Классификация дисперсных систем. Общие свойства растворов. Энергетические эффекты процессов растворения. Виды концентраций: массовая доля, молярная концентрация, молярная концентрация эквивалента. Расчет задач на концентрации. Дисперсная система – смесь двух веществ, при этом одно вещество мелко раздроблено и равномерно распределено в другом веществе. Дисперсная фаза – раздробленное вещество. Дисперсионная среда – вещество, в котором распределена дисперсная фаза. Классификация дисперсных систем: 1. Грубодисперсные (10-4 - 10-7 м) · Сплавы (тв. в тв.) · Порошки (тв. в тв.) · Суспензии (тв. в жид.) · Эмульсии (жид. в жид.) · Аэрозоли (жид. в газ.) 2. Коллоидные (10-7 - 10-9 м) 3. Истинные растворы (менее 10-9 м) Различия между грубодисперсными системами и истинными растворами: 1. Размеры частиц в растворах гораздо меньше. 2. Растворы однородны. 3. В грубодисперсных смесях каждый компонент сохраняет свои свойства, 4.При смешении компонентов раствора, наблюдаются тепловые эффекты, а при смешении компонентов грубодисперсной системы их нет. Механизм растворения: 1. Молекулы растворителя (воды) окружают молекулу растворяемого вещества, образуя вокруг него сольватную (гидратную) оболочку 2. Молекулы или ионы растворяемого вещества, окруженные молекулами растворителя переходят в раствор 3. Процесс растворения происходит до тех пор, пока раствор не станет насыщенным. Растворы – это гомогенные (однородные) системы переменного со- става, состоящие из двух или более компонентов. Растворы могут быть: · твердыми – например, металлические сплавы Au/Ag, Ni/Cu;- · жидкими – наиболее распространенные – растворы солей и кислот- и щелочей; · газообразными – например, воздух: О2 и СО2 и инертные газы в азоте. Раствор состоит из растворителя и растворенного вещества. Энергетические эффекты процессов растворения Растворение твердых веществ в воде сопровождается поглощением или выделением тепла (DHраств. – энергия (энтальпия) растворения). При растворении твердого вещества в воде происходит два процесса: 1) Разрушение кристаллической решетки, требующее затраты энергии – эндотермический процесс (Eкр. реш. > 0); 2) Процесс гидратации – взаимодействие частиц растворенного вещества с молекулами растворителя (воды) с образованием гидратированных частиц – экзотермический процесс (Eгидр. < 0). 3) DHраств.= Eкр.реш. - Eгидр. где DH раств. – энергия (энтальпия) растворения; Eкр.реш. – энергия, затрачивающаяся на разрушение кристаллической решетки; Eгидр. – энергия, выделяемая в процессе гидратации. Общая энергия растворения в зависимости от того, какой из процессов преобладает, может быть положительной или отрицательной. Если |Eкр.реш|.> |Eгидр.| – растворение происходит с поглощением тепла. Если| Eкр.реш. |< |Eгидр.| – растворение происходит с выделением тепла. Концентрация Моль – единица измерения количества вещества. 1 моль (любого вещества) = 6,02 х 1023 молекул Моль – это количество вещества, масса которого, выраженная в граммах, численно равняется его молекулярной массе. 1 моль любого газа при нормальных условиях занимает объем, равный 22,4 л 1. Массовая доля (процентная концентрация) 2. Молярная концентрация - это количество моль растворенного вещества В, содержащего в 1л (дм3) раствора
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1659; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.87.168 (0.014 с.) |

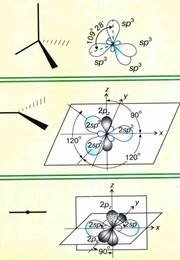 sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (CH4, NH3).
sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (CH4, NH3).  H2S.
H2S. NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
 2NO-Q
2NO-Q
 SO3
SO3