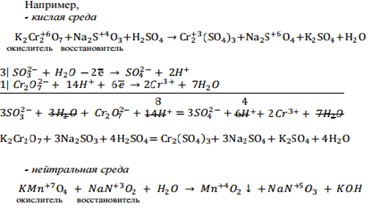Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства металлов. Электродные потенциалы металлов, ряд активности. Взаимодействие металлов с солями, кислотами и основаниями. Коррозия металлов, виды коррозии, борьба с коррозией.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Взаимодействие с простыми веществами 1) С кислородом большинство металлов образует оксиды – амфотерные и основные: 4Li + O2 = 2Li2O, 4Al + 3O2 = 2Al2O3. Щелочные металлы, за исключением лития, образуют пероксиды: 2Na + O2 = Na2O2. 2) С галогенами металлы образуют соли галогеноводородных кислот, например, Cu + Cl2 = CuCl2. 3) С водородом самые активные металлы образуют ионные гидриды – солеподобные вещества, в которых водород имеет степень окисления -1. 2Na + H2 = 2NaH. 4) С серой металлы образуют сульфиды – соли сероводородной кислоты: Zn + S = ZnS. 5) С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании: 3Mg + N2 = Mg3N2. 6) С углеродом образуются карбиды: 4Al + 3C = Al3C4. 7) С фосфором – фосфиды: 3Ca + 2P = Ca3P2. 8) Металлы могут взаимодействовать между собой, образуя интерметаллические соединения: 2Na + Sb = Na2Sb, 3Cu + Au = Cu3Au. 9) Металлы могут растворяться друг в друге при высокой температуре без взаимодействия, образуя сплавы. Электродные потенциалы металлов Стандартный электродный потенциал — это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н+ и ионов испытуемого металла Men+ равны 1 моль-ион/л при стандартных условиях. Ряд стандартных электродных потенциалов служит для сравнительной характеристики свойств атомов и ионов металлов в растворе. Взаимодействие металлов с солями При взаимодействии металлов с солями происходит реакция замещения: электроны от атомов замещающего – более активного металла переходят к ионам замещаемого – менее активного металла. То сеть происходит замещение металла металлом в солях. Данные реакции не обратимы: если металл А вытесняет металл В из раствора солей, то металл В не будет вытеснять металл А из раствора солей. В порядке убывания химической активности, проявляемой в реакциях вытеснения металлов друг друга из водных растворов их солей, металлы располагаются в электрохимическом ряду напряжений (активности) металлов. Металлы, расположенные в этом ряду левее, более активны и способны вытеснять следующие за ними металлы из растворов солей. В электрохимический ряд напряжений металлов включён водород, как единственный неметалл, разделяющий с металлами общее свойство — образовывать положительно заряженные ионы. Поэтому водород замещает некоторые металлы в их солях и сам может замещаться многими металлами в кислотах, например:
Zn + 2HCl = ZnCl2 + H2↑ + Q Металлы, стоящие в электрохимическом ряду напряжений до водорода, вытесняют его из растворов многих кислот (соляной, серной и др.), а все следующие за ним, например, медь не вытесняют. Взаимодействие металлов с кислотами Все реакции неорганической кислоты с металлом приводят к образованию солей. Исключением является, пожалуй, лишь реакция благородного металла с царской водкой, смесью соляной и азотной кислоты. Любое другое взаимодействие кислот с металлами приводит к образованию соли. В случае если кислота не является ни серной концентрированной, ни азотной, то в качестве продукта выщепляется молекулярный водород.
Взаимодействие металлов с основаниями Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды(Al, Zn, Cr и др.) Коррозия металлов, виды коррозии, борьба с коррозией. Коррозией называют разрушение металла под воздействием окружающей среды. Виды коррозии. В зависимости от механизма процесса разрушения металла коррозия может быть химической и электрохимической. Химическая коррозия возникает при действии на металл сухих газов или жидкостей органического происхождения, которые не являются электролитами. Примером химической коррозии служит окисление металла при высоких температурах, в результате чего на его поверхности возникает продукт окисления – окалина. Данный вид коррозии встречается редко. Электрохимическая коррозия образуется в результате воздействия на металл электролитов (растворов кислот, щелочей и солей В зависимости от характера окружающей среды электрохимическая коррозия может быть: атмосферной, подводной, почвенной, вызванной блуждающими токами. Существуют различные методы защиты металлов от коррозии: Лакокрасочные покрытия – наиболее распространенный вид антикоррозионной защиты металла. В качестве пленкообразующих материалов используют нитроэмали, нефтяные, каменноугольные и синтетические лаки, краски на основе растительных масел и др. Образующаяся при покрытии на поверхностях конструкций плотная пленка изолирует металл от воздействия окружающей его влажной среды.
Неметаллические покрытия довольно разнообразны. К ним относят эмалирование, покрытие стеклом, цементно-казеиновым составом, листовым пластиком и плитками, напыление пластмасс. Металлические покрытия наносят на металлы гальваническим, химическим, горячим, металлизацией и другими способами. При гальваническом способе защиты на поверхности металла путем электролитического осаждения из раствора солей металлов создается тонкий защитный слой какого-либо металла. Химическая обработка поверхности металла – изделия погружают в ванну с расплавленным защитным металлом. Металлизация – распространенный способ защиты металлов в строительстве. Он состоит в нанесении сжатым воздухом тончайшего слоя распыленного расплавленного металла. При защите легированием в металл вводят легирующие элементы, повышающие сопротивление сплава коррозии. Защита от огня. Для защиты металлоконструкций наиболее перспективны вспучивающиеся покрытия или краски на основе полимерных связующих, которые при воздействии огня образуют закоксовавшийся вспененный расплав, препят-ствующий нагреву металла. Для повышения предела огнестойкости (600 °С) металлических, в том числе алюминиевых, конструкций применяют также асбестоцементные, асбестоперлитовые, асбестовермикулитовые покрытия, наносимые пневмонапылением. Новый вид огнезащиты – фосфатное покрытие толщиной 20-30 мм, представляющее собой стойкую (при 1000 °С) монолитную легкую массу. Традиционные способы увеличения предела огнестойкости, использование облицовок и штукатурок из несгораемых огнезащитных материалов (кирпича, пустотелой керамики, гипсовых плит, растворов и др.). Вопрос 11. Типы химических реакций. Окислительно-восстановительные реакции: реакции межмолекулярного, внутримолекулярного окисления-восстановления, реакции самоокисления самовосстановления. Методы электронного и электронно-ионного баланса. ТИПЫ КЛАССИФИКАЦИИ РЕАКЦИИ:
По тепловому эффекту:
По присутствию других веществ:
Окислительно-восстановительными называют реакции, происходящие с изменением степеней окисления элементов, входящих в состав взаимодействующих веществ. Степенью окисления атома в молекуле называют условный заряд, возникающий при смещении электронной пары к более электроотрицательному атому. Степень окисления подсчитывают, исходя из того, что сумма степеней окисления всех атомов в молекуле вещества равна нулю.
Окислитель присоединяет электроны и при этом восстанавливается (понижает свою степень окисления). Вещества, в состав которых входят элементы с максимальной степенью окисления, всегда являются окислителями. Восстановитель отдает электроны и при этом окисляется (повышает свою степень окисления). Вещества, содержащие элементы с минимальной степенью окисления всегда являются восстановителями. Таким образом, в окислительно-восстановительных реакциях происходит следующий процесс: окислитель(I) + восстановитель(II) ⇆ восстановитель(I) + окислитель(II) Если в состав вещества входят элементы с промежуточной степенью окисления, то такие вещества могут проявлять как окислительные, так и восстановительные свойства. Для составления уравнений окислительно-восстановительных реакций нужно знать окислительно-восстановительные свойства исходных веществ, на основании которых устанавливают состав продуктов реакции. Если известна схема реакции (исходные вещества и продукты), то остается расставить стехиометрические коэффициенты. Для этой цели применяют методы электронного баланса и ионно-электронный. Для реакций, протекающих в растворах, чаще всего используют ионно-электронный метод, сущность которого заключается в том, что для составления полуреакций процессов окисления и восстановления берут реально существующие в растворе ионы. Для составления реакций окисления-восстановления следует: 1. Учитывать, в какой среде протекает окислительно- восстановительная реакция. 2. Написать уравнение реакции в молекулярной и ионной форме. 3. Выбрать ионы или молекулы, в которых элементы меняют степень окисления, т.е. выбрать окислитель и восстановитель. 4. Уравнять количество элементов в правовой и левой частях (в кислой среде при наличие кислорода он уравнивается молекулой воды, в щелочной кислород уравнивается удвоенным количеством гидроксильных групп, в нейтральной среде – слева только вода). 5. Уравнять количество зарядов в правой и левой частях путем добавления или отнятия электронов. 6.Уравнять число электронов, отданных восстановителем и принятых окислителем. 7. Сложить уравнения полуреакций с учетом найденных коэффициентов. Сократить одноименные ионы и молекулы, встречающиеся в обеих частях уравнения.
8. Расставить коэффициенты в уравнении реакции.
Вопрос 12.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 3010; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.151.112 (0.01 с.) |


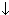 NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
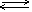 2NO-Q
2NO-Q
 SO3
SO3