
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
А.И.Конопля, О.В. Хорлякова, Н.А.БыстроваСодержание книги
Поиск на нашем сайте
Министерства здравоохранения Российской Федерации Кафедра биологической химии А.И.Конопля, О.В. Хорлякова, Н.А.Быстрова
ЗАДАНИЯ для самоподготовки по биологической химии для студентов фармацевтического факультета Заочной формы обучения Курск – 2013 Государственное бюджетное образовательное учреждение высшего профессионального образования «Курский государственный медицинский университет» Министерства здравоохранения Российской Федерации Кафедра биологической химии А.И.Конопля, О.В. Хорлякова
ЗАДАНИЯ для самоподготовки по биологической химии для студентов фармацевтического факультета Заочной формы обучения Курск – 2013 УДК: 577.1(072) Печатается по решению редакционно- ББК:28.707.2я7 издательского совета ГБОУ ВПО КГМУ Минздрава России
Конопля А.И., Хорлякова О.В. Задания для самоподготовки по биологической химии для студентов фармацевтического факультета заочной формы обучения (3-е изд., испр. и перераб.). - Курск: Изд-во КГМУ, 2013. – 1 электрон. Опт. Диск (CD-ROM). Рецензенты: заведующая кафедрой фундаментальной и клинической биохимии с ла-бораторной диагностикой биохимии с лабораторной диагностикой ГБОУ ВПО СамГМУ Минздрава России, доктор медицинских наук, профессор, заслуженный деятель науки РФ Ф.Н. Гильмиярова заведующая кафедрой общей химии ГБОУ ВПО КГМУ Минздрава России, доктор фармацевтических наук, профессор Е.В. Будко
Задание на самоподготовку содержит 8 разделов, разработаные на кафедре биологической химии в соответствии с Федеральным государственным стандартом третьего поколения. Задания содержат детально разработанный план изучения учебного материала по темам. В них дана ориентировочная основа действия студентов во время самоподготовки и ориентировочная основа действия на практическом занятии. В него включены вопросы и задачи для самоконтроля, которые помогут применять знания в ситуациях, приближенных к практической деятельности. Работа с заданиями позволит студентам более углубленно изучить материал, развивать логическое мышление, систематизировать теоретические знания с соответствующим преломлением их для практики. В заданиях для каждого раздела внесено описание лабораторных работ, которые буду выполняться на практических занятиях, приведен перечень основной и дополнительной литературы, необходимой для освоения учебного материала. Кроме этого, в заданиях имеется перечень учебно-методических материалов, изданных кафедрой биологической химиии КГМУ и типовые экзаменационные вопросы.
Требования к результатам освоения дисциплины После освоения дисциплины студент должен: Знать: - химическую природу и роль основных биомолекул, химические явления и процессы, протекающие в организме на молекулярном уровне; - магистральные пути метаболизма аминокислот, белков, углеводов, липидов, нуклеотидов, нуклеиновых кислот, нарушения их метаболизма в организме человека; - основы биоэнергетики; - пути реализации анаболических и катаболических реакций клетки; - этапы гомеостаза клетки и репликации ДНК и биосинтеза белка; - строение и функции наиболее важных органических соединений: белков, углеводов, липидов, нуклеиновых кислот; - основные механизмы регуляции метаболических превращений белков, липидов, углеводов; - принципы биохимического анализа и клинико-биохимической лабораторной диагностики заболеваний и анализе лекарственных средств; - применение биохимических методов в производстве и анализе лекарств; - правила техники безопасности в химической лаборатории; - теоретические основы путей ферментативного превращения лекарств в организме; - сведения о молекулярных механизмах наследственных и ряда других заболеваний. Уметь: - оценивать информативность различных биохимических показателей при некоторых патологических состояниях; - интерпретировать результаты наиболее распространенных методов лабораторной диагностики; - определять содержание некоторых компонентов белкового, углеводного и липидного обменов в биохимических жидкостях; - использовать измерительное оборудование при выполнении биохимических исследований; - определять количество белковых фракций в крови; - оценивать информативность биохимических определений для анализа крови и мочи при некоторых патологических состояниях (сахарный диабет, патология печени, почек, сердца);
- определять по содержанию продуктов метаболизма ксенобиотиков в биохимических жидкостях превращение данного лекарственного вещества в организме; - определять содержание основных компонентов в крови и биохимических жидкостях; - самостоятельно работать с учебной и справочной литературой; - самостоятельно выполнять научно-исследовательскую работу; - участвовать в решении отдельных научно-исследовательских и научно-прикладных задач по разработке новых методов и технологий в области фармации; - участвовать в разработке рабочих планов и программ проведения научных исследований, выбор методик и средств решения задачи, подготовка отдельных заданий для исполнителей; - выполнять сбор, обработку, анализ и систематизацию научно-технической информации по теме исследования; - использовать измерительное оборудование при выполнении биохимических исследований; - выполнять тестовые задания в любой форме, решать ситуационные задачи на основе теоретических знаний. - проводить элементарную статистическую обработку экспериментальных данных в химических и биохимических экспериментах; - проводить лабораторные опыты, объяснять суть конкретных реакций и их аналитические эффекты, оформлять отчетную документацию по экспериментальным данным; - собирать простейшие установки для проведения лабораторных исследований, пользоваться приборами. Владеть: - лабораторными биохимическими исследованиями с биохимическими жидкостями; - определяет в них некоторые компоненты белкового, некоторые компоненты белкового, углеводного, липидного обменов; - использовать свои знания для решения биохимических и профессиональных задач; - некоторыми методами определения содержания аминокислот, белков, жиров, стеролов, сахаров, которые используются в фарманализе и диагностике заболеваний; - навыками работы с химической посудой и простейшими приборами; - техникой работы на физических приборах, используемых для качественного и количественного анализа; - простейшими навыками по постановке и проведению качественных реакций с органическими соединениями; - навыками дифференциации причин и условий возникновения болезней, клинической оценки эффективности лекарственной терапии; - навыками проведения научных исследований для установления взаимосвязи физико-химических свойств и фармакологической активности; - измерять и оценивать нарушения основных функциональных показателей жизнедеятельности человека при патологии.
Процесс изучения дисциплины направлен на формирование следующих компетенций: ПК-1, ПК-36, ПК-47,ПК-48, ПК-49. В результате изучения биохимии студент должен обладать следующими профессиональными компетенциями (ПК): способностью и готовностью применять основные методы, способы и средства получения, хранения, переработки научной и профессиональной информации; получать информацию из различных источников, в том числе с использованием современных компьютерных средств, сетевых технологий, баз данных и знаний (ПК-1);
в области контрольно-разрешительной деятельности: способностью иготовностьюинтерпретировать и оцениватьрезультаты анализа лекарственных средств (ПК-36); в области научно-исследовательской и информационно-просветительской деятельности:
способностью и готовностью к проведению информационно-просветительской работы по пропаганде здорового образа жизни и безопасности жизнедеятельности (ПК-47); способностью и готовностью работать с научной литературой, анализировать информацию, вести поиск, превращать прочитанное в средство для решения профессиональных задач (выделять основные положения, следствия из них и предложения) (ПК-48); способностью и готовностью к участию в постановке научных задач и их экспериментальной реализации (ПК-49). Содержание компетенций и планируемый уровень развития компетенций в результате изучения дисциплины
ВВЕДЕНИЕ Современная фармация развивается на базе достижений медико-биологических отраслей науки. Важная роль в этом процессе принадлежит биологической химии, являющейся теоретической основой для выявления закономерности функционирования многих физиологических систем в норме и патологии. Целью изучения биологической химии в медицинских ВУЗах является формирование у будущего провизора четких представлений о взаимосвязи между структурой, свойствами, обменом и функциями различных соединений в живой клетке и целостном организме; механизмах регуляции и нарушения обмена и функций различных соединений; принципах биохимической диагностики и коррекции нарушений обменных процессов. ПРИСТУПАЯ К ИЗУЧЕНИЮ БИОЛОГИЧЕСКОЙ ХИМИИ, ВНИМАТЕЛЬНО ОЗНАКОМЬТЕСЬ СО СТРУКТУРОЙ НАСТОЯЩИХ МЕТОДИЧЕСКИХ РЕКОМЕНДАЦИЙ. Задание на самоподготовку в каждом из 8 разделов состоит из мотивационной установки, формулировки цели и задач изучения раздела, по каждой теме раздела из вопросов для самоконтроля, необходимых для усвоения данной темы, вопросов и упражнений для самоконтроля, описания лабораторных работ, выполняемых на практических занятиях, перечня литературы, необходимой для изучения дисциплины. МОТИВАЦИОННЫЕ УСТАНОВКИ показывают значение данной темы для усвоения последующих тем биологической химии, смежных дисциплин и подготовки квалифицированного специалиста. ЦЕЛЬ И ЗАДАЧИ ИЗУЧЕНИЯ ТЕМЫ определяют конечный результат, который должен быть достигнут в результате самоподготовки и работы на практическом занятии. ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ для каждой темы позволят выделить и усвоить наиболее существенный учебный материал. ВОПРОСЫ И УПРАЖНЕНИЯ ДЛЯ САМОКОНТРОЛЯ помогут научиться применять теоретические знания в конкретных ситуациях, по возможности приближенных к практической деятельности. ЛАБОРАТОРНЫЕ РАБОТЫ, которые будут выполняться на практических занятиях помогут в освоении теоретического материала дисциплины и станут основой для освоения практических навыков, предусмотренных ФГОС 3-го поколения по биологической химии. ОБЯЗАТЕЛЬНЫМ ПРИ ПОДГОТОВКЕ К КАЖДОЙ ТЕМЕ ЯВЛЯЮТСЯ УЧЕБНИК ПО БИОЛОГИЧЕСКОЙ ХИМИИ И КОНСПЕКТЫ ЛЕКЦИЙ. ЛИТЕРАТУРА ДЛЯ ИЗУЧЕНИЯ БИОЛОГИЧЕСКОЙ ХИМИИ. Перечень литературы состоит из 4 разделов. В первом разделе представлена основная литература, которая имеется в библиотеке, читальных залах или в электронном виде (доступ ЭБС «Консультант студента», карточки для доступа имеются во всех читальных залах или у старост групп). Во втором разделе приведена дополнительная литература для более углубленного изучения и детализации отдельных тем (находится в читальных залах и библиотеке КГМУ). В третьем разделе представлены методические указания и учебные пособия, изданные сотрудниками кафедры биохимии и необходимые для самоподготовки к занятиям и самостоятельной работе по закреплению знаний. Многие из этих материалов в библиотеке и читальных залах КГМУ есть в электронном виде и по желанию студента могут быть копированы для личного пользования. ОРИЕНТИРОВОЧНАЯ ОСНОВА ДЕЙСТВИЯ СТУДЕНТОВ ВО ВРЕМЯ САМОПОДГОТОВКИ ОСНОВНАЯ ЦЕЛЬ САМОПОДГОТОВКИ – получение новых знаний и включение их в свой толковый словарь.
СТУДЕНТОВ НА ЗАНЯТИИ На лабораторных занятиях необходимо научиться использовать знания, приобретенные во время самоподготовки, для получения новой информации решения конкретных задач. Она достигается в процессе выполнения лабораторных работ, собеседования с преподавателем по наиболее сложным вопросам темы, решения проблемных задач.
ЗАДАЧИ ИЗУЧЕНИЯ РАЗДЕЛА. Знать: структуру аминокислот, пептидную связь; – значение первичной структуры белков, определяющей их структурное и функциональное многообразие; – уровни структурной организации белков; – химические и энергетические особенности связей и взаимодействий, стабилизирующих различные уровни организации молекулы; – причины и следствия денатурации белков, факторы вызывающие денатурацию; – примеры использования денатурирующих факторов в медицине; – основные методы разделения и очистки белков; – классификацию и номенклатуру ферментов; – структурно-функциональную организацию ферментов; – механизм действия ферментов; – кинетику ферментативных реакций; – общие свойства ферментов; – принципы применения препаратов белка и ферментов в медицине. Уметь: выполнять качественные и количественные реакции определения белка; - определять активность некоторых ферментов в биологических жидкостях.
Вопросы, задачи и упражнения для самоконтроля 1. Выберите характеристики аминокислот, входящих в состав белков: а) α-аминокислоты; б) в состав белков входят все 20 из известных протеиногенных аминокислот; в) различаются боковыми радикалами; г) в составе радикала всегда имеется гидрофильная функциональная группа; д) среди аминокислот имеется иминокислота.
2. Укажите аминокислоты, которым принадлежат следующие радикалы:
3. Классифицируйте кислоты по полярности радикалов:
4. Напишите реакцию взаимодействия двух молекул цистеина, приводящую к образованию ковалентной дисульфидной связи за счет окисления обеих тиоловых групп. Как называется образовавшаяся аминокислота? 5. Какие нестандартные аминокислоты, встречающиеся в белках, могут образовываться путем модификации (гидроксилирования) аминокислот основного набора после их включения в полипептидную цепь? 6. Какие Вы знаете незаряженные производные аспарагиновой и глутаминовой кислот? Напишите их формулы. 7. Смесь аминокислот – глицина, аланина, глутаминовой кислоты, лизина, аргинина, гистидина – анализировали с помощью метода электрофореза на бумаге в буфере с рН = 6,0. Какие из этих аминокислот будут двигаться к аноду, катоду, останутся на старте? 8. Напишите формулы аспарагиновой кислоты, серина, аргинина в нейтральной, кислой и основной средах. При разделении этих аминокислот методом электрофореза на бумаге в буфере с рН=7,0 покажите их движение (к аноду, катоду, останутся на старте). 9. Укажите соответствие: функциональная группа в радикале аминокислоты:
А) Карбоксильная 1. Арг Б) Гидроксильная 2. Цис В) Гуанидиновая 3. Тир Г) Тиольная Д) Аминогруппа 10. Выберите правильные ответы: Аминокислоты с полярными незаряженными радикалами – это: А. Цис Б. Асп В. Глу Г. Три. Тре Вопросы, задачи и упражнения для самоконтроля 1. Напишите формулу гексапептида Лиз-Вал-Глу-Фен-Ала-Асп.
а) Выделите в пептиде повторяющиеся группы, образующие пептидный остов, и вариабельные группы, представленные радикалами аминокислот. б) Подчеркните пептидные связи. в) Напишите другой пептид, состоящий из тех же аминокислот. 2. Выберите из представленных пар аминокислот консервативные и радикальные замены: 1. гли – ала; 2. глу – вал; 3. асп – глу; 4. тир – фен; 5. вал – лей.
3. Пользуясь приводимой ниже последовательностью аминокислотных остатков в окситоцине (1), вазопрессине быка (2) и вазопрессине свиньи (3): а) проиллюстрируйте принцип взаимозаменяемости аминокислот; б) выделите аминокислоту, обусловливающую видовую специфичность вазпрессина. 4. Какая форма полипептидной цепи термодинамически более выгодна в водном растворе – полностью развернутая цепь или клубок? Обоснуйте свой ответ. Цис – тир – илей – глу – асп – цис – про – лей – гли; Цис – тир – фен – глу – асп – цис – про – арг – гли; Цис – тир – фен – глу – асп – цис – про – лиз – гли. 5. Систематизируйте представленный в учебниках материал с помощью таблицы:
6. Проведите сравнительную характеристику структуры и свойств миоглобина и гемоглобина с помощью таблицы:
7. Выберите правильные ответы. Радикалы аминокислот: А. Обеспечивают специфичность первичной структуры. Б. Участвуют в формировании третичной структуры. В. Располагаясь на поверхности белка, влияют на растворимость. Г. Формируют активный центр. Д. Участвуют в образовании пептидных связей.
8. Выберите правильные ответы. Водородные связи могут образовываться между радикалами аминокислот: А. Сер Гли Б. Цис Тре В. Асп Лиз Г. Глу Асп Д. Асн Тре
9. Выберите правильные ответы. Гидрофобные взаимодействия могут образовываться между радикалами аминокислот? А. Тре Лей Б. Про Три В. Мет Иле Г. Тир Ала Д. Вал Фен
10. Выберите правильные ответы. Ионные связи могут образовываться между радикалами аминокислот: А. Гли Асп Б. Арг Лиз В. Лиз Глу Г. Гис Асп Д. Асн Арг Вопросы, задачи и упражнения для самоконтроля 1. Оптимальные условия действия лактатдегидрогеназы, катализирующей реакцию превращения пирувата в лактат: температура – 37°С, рН – 7,5. Объясните причины уменьшения активности фермента: 1. при повышении температуры до 60°С; 2. во время хранения ферментного препарата при рН – 5,0. 2. Какой оптимум рН у: 1. амилазы слюны; 2. пепсина; 3. химотрипсина. 3. Существует количественная зависимость между концентрацией субстрата и скоростью ферментативной реакции. Эта зависимость выражается уравнением Михаэлиса-Ментен. Напишите уравнение Михаэлиса-Ментен. Какой вид принимает это уравнение при очень низких и очень высоких концентрациях субстрата? 4. Нарисуйте кривую зависимости между концентрацией субстрата и скоростью ферментативной реакции, катализируемой регуляторным ферментом. Сравните эту кривую с кривой Михаэлиса-Ментен. Чем объясняется отличие кривых? 5. Зависимость скорости реакции, катализируемой транскарбамоилазой, от концентрации субстрата выражается кривой, имеющей сигмоидную форму. После обработки фермента солями ртути каталитическая активность увеличилась примерно в 4 раза, а кривая зависимости скорости реакции от концентрации субстрата приобрела форму гиперболы. Нарисуйте график, иллюстрирующий приведенные данные. Какие выводы о структуре и внутримолекулярных взаимодействиях в ферменте можно сделать на основании этих данных?
Вопросы, задачи и упражнения для самоконтроля. 1. Определите тип ингибирования, проанализировав приведенные ниже данные зависимости степени ингибирования фермента глутаматдегидрогеназы аспартатом и салицилатом. Требуется учесть, что в обоих случаях активность фермента можно восстановить, удалив ингибитор. Ответьте на вопросы: 1. Какое из веществ является конкурентным ингибитором, какие результаты это доказывают? 2. Какой метод можно использовать для удаления ингибитора? Ингибирование аспартатом (концентрация аспартата постоянна)
Ингибирование салицилатом (концентрация салицилата постоянна)
2. Обратимо ли действие ингибиторов в следующих реакциях? Требуется обосновать ответ, используя данные по инактивации ферментов, приведенные в уравнениях. а) СООН СООН | СООН–(СН2)–С–СООН |
| О | СН2 СН2
СHNН2 СН2NH2 | глутаматдекарбоксилаза СООН б) Фермент–SH + JCH2COOH Фермент–S–СН2СООН + HJ активный фермент неактивный фермент 3. Укажите правильный ответ или ответы. Лекарства – ингибиторы ферментов: 1. являются исключительно необратимыми ингибиторами; 2. часто похожи на промежуточные соединения реакции; 3. могут взаимодействовать с несколькими ферментами; 4. изменяют структуру образованного продукта реакции. 4. Выберите наиболее полный ответ. Регулировать активность ферментов можно: 1. с помощью аллостерического лиганда; 2. путем фосфорилирования и дефосфорилирования; 3. специфическим гидролизом пептидных связей; 4. изменив конформацию активного центра; 5. с помощью белков-ингибиторов. 5. Аллостерический фермент: 1. это часто олигомерный белок; 2. имеет каталитические и аллостерические центры, которые всегда локализованы в разных протомерах; 3. аллостерическим эффектором для него может быть субстрат; 4. аллостерическим эффектором может быть конечный продукт метаболического пути; 5. присоединяет эффектор и при этом изменяется конформация всех протомеров. 6. Неактивная форма фермента пепсина – одна полипептидная цепь – имеет молекулярную массу 42000 Д. После добавления к раствору этого белка HCl молекулярная масса белка уменьшилась до 25000 Д и фермент стал активным. Выберите возможные причины активации фермента: 1. изменение рН; 2. отщепление субъединиц; 3. фосфорилирование; 4. изменение первичной структуры; 5. метилирование. 7. Модуляторами регуляторного фермента могут быть молекулы субстрата и молекулы продукта реакции, катализируемой ферментом. Как изменяется скорость реакции, катализируемой регуляторными ферментами, под влиянием субстрата и под влиянием продукта реакции? Какое биологическое значение имеет каждый из этих типов модуляции?
Цикл трикарбоновых кислот. ЗАДАЧИ ИЗУЧЕНИЯ РАЗДЕЛА Усвоить: структуру и функцию окислительно-восстановительных ферментов; – взаимосвязь между процессами распада углеводов и энергообеспечением организма; – представления о субстратных и гормональных механизмах регуляции обмена углеводов; Знать: организацию работы дыхательной цепи; – принципы аккумулирования энергии окислительно-восстановительных процессов; – принципы регуляции окислительногофосфорилирования; – причины и механизм нарушения окислительного фосфорилирования. – особенности обмена углеводов в различных органах – печени, мышцах, мозге, жирорастворимой ткани, эритроцитах; – причины нарушений обмена углеводов при сахарном диабете, злокачественных опухолях, инфаркте миокарда, гликогенозах.
Вопросы, задачи и упражнения для самоконтроля. 1. Последовательность реакций в цепи переноса электронов (ЦПЭ) определяется: 1. строением окисляемого субстрата; 2. величинами окислительно-восстановительных потенциалов компонентов ЦПЭ; 3. локализацией ферментов в митохондриальной мембране; 4. прочностью связи апоферментов с коферментами; 5. налич |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 277; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.166.141 (0.019 с.) |







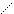 2) СН3
2) СН3
 –СН2–СН
СН3
3) –(СН2)2–S–СН3;
4) –(СН2)3–СН2NН2.
–СН2–СН
СН3
3) –(СН2)2–S–СН3;
4) –(СН2)3–СН2NН2.
 СН2 || СН2
СН2 || СН2





