
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Фотоколориметрическое определение ниацина (витамина РР)Содержание книги
Поиск на нашем сайте
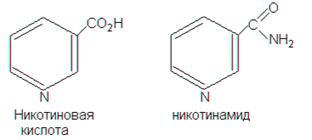
Ниацин является коферментом большой группы ферментов дегидрогеназ. При недостатке витамина РР в организме наблюдается вялость, быстрая утомляемость, бессонница, сердцебиение и пониженная сопротивляемость к инфекционным болезням. К ниацину относятся 2 химических соединения: Источники витамина РР – мясные продукты и рыба. В злаковых и продуктах их переработки витамин РР находится в связанной форме. Сущность метода. Метод основан на освобождении связанных форм ниацина путем гидролиза, очистка гидролизата от мешающих определению веществ, количественном производного глутаконового альдегида и колориметрическом определении его массовой доли при 400-425 нм в сравнении со стандартным раствором. Приборы и реактивы: колориметр фотоэлектрический; весы лабораторные; электроплитка; баня водяная; автоклав; центрифуга; эксикатор; фарфоровая ступка с пестиком; мерная колба на 50 см3; мерный цилиндр на 100 см3; коническая колба на 250 см3; кислота никотиновая; 0,05 моль/дм3, 1,0 моль/дм3, 2,5 моль/дм3 растворы серной кислоты; 0,5 моль/дм3 раствор соляной кислоты; 4,0 моль/дм3, 10 моль/дм3 растворы гидроксида натрия; бром; 100 г/дм3 и 10 г/дм3 растворы роданистого калия (или роданистого аммония); карбонат кальция; окись кальция; метол, перекристаллизованный 80 г/дм3 раствор в 0,5 моль/дм3 растворе соляной кислоты; спирт этиловый; 800 г/дм3 раствор сульфата цинка; толуол; 1 % раствор фенолфталеина; активированный уголь; фильтры. Методика выполнения работы В зависимости от свойств исследуемого продукта для освобождения связанных форм ниацина используют различные виды гидролиза. При определении ниацина в мясе, рыбе, яйцах применяют гидролиз с 1 моль/дм3 раствором серной кислоты. При анализе хлебобулочных, крупяных и макаронных изделий, молока, творога, плодов и овощей проводят щелочной гидролиз с Са(ОН)2, который образует с сахарами и крахмалом соединения, малорастворимые в охлажденных растворах. В результате гидролизат содержит меньше соединений, мешающих определению. В фарфоровую ступку взять навеску пробы (зерна, муки, хлеба, сырое и вареное яйцо) 10 г. При кислотном гидролизе навески добавить небольшое количество 1,0 моль/дм3 раствора серной кислоты и тщательно растереть в ступке. Затем количественно перенести в мерную колбу на 50 см3 с помощью 1,0 моль /дм3 раствора серной кислоты. Весь объем используемого раствора серной кислоты должен составлять 40 см3. Колбу поместить на 90 минут в кипящую водяную баню, периодически перемешивая содержимое. По окончании гидролиза охладить колбу до комнатной температуры, довести объем гидролизата дистиллированной водой до метки, перемешать, отфильтровать (первые 3-5 см3 фильтрата отбросить). 25 мл фильтрата поместить в мерный цилиндр емкостью 100 см3, добавить 1- 2 капли 10 моль/дм3 фенолфталеина, нейтрализовать раствором гидроокиси натрия до слабо-розового окрашивания и охладить. Объем гидролизата довести водой до 50 см3, перемешать и отфильтровать. При щелочном гидролизе к навеске добавить 10 см3 водной суспензии гидроокиси кальция, тщательно растереть в ступке и количественно перенести в коническую колбу на 250 см3 с помощью 40 см3 дистиллированной воды. Содержимое перемешать и колбу поместить в кипящую водяную баню на 90 минут. По окончании гидролиза колбу охладить до комнатной температуры, содержимое перенести в мерный цилиндр на 100 см3 и объем довести до 75 см3 дистиллированной водой, перемешать и поместить на ночь в холодильник. Охлажденный гидролизат отфильтровать. 25 см3 фильтрата внести в мерный цилиндр на 100 см3, добавить 1-2 капли фенолфталеина и по каплям 2,5 моль/дм3 раствором серной кислоты довести до обесцвечивания. В цилиндр с нейтрализованным фильтратом внести 2 см3 раствора сульфата цинка и добавить по каплям 4 моль/дм3 раствор гидроокиси натрия. Содержимое цилиндра перемешать стеклянной палочкой, розовое окрашивание удалить несколькими каплями 2,5 моль/дм3 раствора серной кислоты. Оставить стоять на 10 минут, затем добавить 1-2 капли этилового спирта (для удаления пены) и довести объем дистиллированной водой до 50 см3, перемешать и отфильтровать через складчатый фильтр. Цветную реакцию проводят в пробирках с притертыми пробками. В одну пробирку внести 5 см3 дистиллированной воды (контроль) в две пробирки внести по 5 см3 рабочего стандартного раствора ниацина; в четыре пробирки внести по 5 см3 очищенного гидролизата испытуемого образца. Все пробирки на 5 минут поместить на водяную баню при 500С, после чего в две пробирки с гидролизатом добавить 2 см3 дистиллированной воды (контроль к испытуемому раствору), а в остальные пробирки по 2 см3 роданбромидного раствора из бюретки в вытяжном шкафу. Содержимое перемешать встряхиванием. Затем все пробирки поставить на 10 минут в темное место, добавить по 3 см3 раствора метола, перемешать и оставить на 1 час в темном месте. Оптическую плотность раствора измерить по отношению к воде на фотоэлектроколориметре со светофильтром, дающим длину волны 400-425 нм. Если растворы мутные, перед фотокалориметрированием их фильтруют в кювету через бумажный фильтр. Оформление результатов Полученные результаты записать в таблицу 16. Таблица 16.
Массовую концентрацию ниацина (х) в мг на 100 г продукта вычисляют по формуле:
где
10 – коэффициент пересчета из мкг/г в мг/100 г продукта
7.3.2 Опыт 2. Фотоколориметрический метод определения аскорбиновой кислоты Метод основан на экстракции аскорбиновой кислоты из продукта раствором кислоты, восстановлении 2,6–дихлорфенолиндофенолятом натрия аскорбиновой кислоты с последующей экстракцией органическим растворителем (ксилолом или бутилацетатом) избытка 2,6-дихлорфенолиндофенолята натрия и фотометрирование этого экстракта при λ=490 нм. Приборы и реактивы: колориметр фотоэлектрический; весы лабораторные; 2 % раствор соляной или щавелевой кислоты; раствор аскорбиновой кислоты концентрации 1,0 г/дм3 и 0,1 г/дм3; насыщенный раствор гидрохинона в ацетоне.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-18; просмотров: 253; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.10.207 (0.008 с.) |


 - оптическая плотность испытуемого раствора (среднее из двух параллельных определений) ед. прибора;
- оптическая плотность испытуемого раствора (среднее из двух параллельных определений) ед. прибора;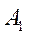 - оптическая плотность раствора контроля к испытуемому раствору (среднее из двух параллельных определений), ед. прибора;
- оптическая плотность раствора контроля к испытуемому раствору (среднее из двух параллельных определений), ед. прибора; - масса ниацина в 5 мл рабочего стандартного раствора, мкг;
- масса ниацина в 5 мл рабочего стандартного раствора, мкг; - общий объем гидролизата, мл;
- общий объем гидролизата, мл; - объем после очистки гидролизата сульфатом цинка, мл;
- объем после очистки гидролизата сульфатом цинка, мл; - оптическая плотность стандартного раствора (среднее из двух параллельных определений), ед. прибора;
- оптическая плотность стандартного раствора (среднее из двух параллельных определений), ед. прибора; - оптическая плотность раствора контроля на реактивы, ед. прибора;
- оптическая плотность раствора контроля на реактивы, ед. прибора; - масса пробы, взятой для анализа, г;
- масса пробы, взятой для анализа, г; - объем гидролизата, взятый на очистку, мл;
- объем гидролизата, взятый на очистку, мл; - объем очищенного гидролизата, взятый для проведения цветной реакции, мл;
- объем очищенного гидролизата, взятый для проведения цветной реакции, мл;


