
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изменение концентрации одного из реагирующих веществСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
в единицу времени . 3. скорость реакции вычисляется как частное от деления разности концентраций одного из реагирующих веществ на промежуток времени, в течение которого произошло это изменение концентрации. Δ С Vобр = + ---------- = моль/ л.с. Δ t
4.Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры, катализаторов, давления и др.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
V = k • [A]m • [B]n
6.При повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2 - 4 раза.
7.Катализаторы − вещества, изменяющие скорость химической реакции.
II. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ, ИХ КЛАССИФИКАЦИЯ.
Химических реакций очень много. Для того, чтобы легче было их изучать, химические реакции классифицируют по определенным признакам. Существует несколько классификаций химических реакций.
I. Классификация по признаку изменения числа и состава исходных веществ и продуктов реакции: 1.Реакция соединения − это реакции, в результате которой из двух или нескольких веществ образуется одно новое вещество. Например: 2Сu + O2 = 2СuО СаО + Н2O = Са(ОН)2 Общая схема реакций соединений:
2.Реакция разложения − это реакция, в результате которой из одного вещества образуется несколько новых веществ.
Например: t0 СаСО3 ═ СаО + СО2↑ Общая схема реакций разложений:
3. Реакция замещения - это реакция между простыми и сложными веществами, при протекании которых атомы простого вещества замещают атомы одного из элементов в молекуле сложного вещества. В результате реакции замещения образуется новое простое и новое сложное вещество.
Например: Fe + CuSO4 = FeSO4 + Cu Zn + 2 HCl = ZnCl2 + H2↑ Общая схема реакций замещения:
4.Реакция обмена − это реакция между двумя сложными веществами, при протекании которых их молекулы обмениваются своими составными частями. В результате реакций обмена образуются два новых сложных вещества. Например FeCl3 + 3 NaOH = 3 NaCl + Fe(OH)3 NaOH + HCl = NaCl + H2O Общая схема реакций обмена:
II. Классификация по признаку обратимости.
2. Необратимые: Н2SO4 + 2 NaОН = NаSO4 + 2Н2O AgNO3 + NaBr = AgBr ↓ + NaNO3 Большинство химических реакций являются обратимыми.
III. Классификация по тепловому эффекту реакции
1. Экзотермические (ΔH < О): (многие реакции соединения)
Fe + S = FeS; ΔH = − 96 кДЖ C +O2 = CO2 +Q; ΔH = − 394 кДЖ 2. Эндотермические (Δ Н < О): (многие реакции, разложения)
2 HgO = 2 Hg + O2; Δ Н = + 180 кДж СаСОЗ = СаО + СО2↑- Q; Δ Н = + 1200 кДж
|
|||||
|
Последнее изменение этой страницы: 2017-01-18; просмотров: 453; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.106.38 (0.008 с.) |

 А + В +... С
А + В +... С С А + В+...
С А + В+... АВ + С АС + В
АВ + С АС + В
 1. Обратимые: 2 SO2 + O2 2 SO3
1. Обратимые: 2 SO2 + O2 2 SO3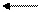
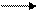 N2 + 3 H2 2 NH3
N2 + 3 H2 2 NH3


