Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химический состав и особенности обменаСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
БИОХИМИЯ ТКАНЕЙ Учебное пособие для преподавателей и студентов
ЧИТА 2000
Учебное пособие составлено доцентом кафедры биохимии А.Ц. Гомбоевой Под общей редакцией профессора кафедры биохимии ЧГМА Л.П. Никитиной
Рецензенты: зав. кафедрой биохимии профессор Л.П. Никитина, зав. кафедрой нормальной физиологии профессор Л.П. Малежик, зав. кафедрой гистологии доцент М.А. Джулай
Одобрено центральной методической комиссией Читинской государственной медицинской академии.
ОГЛАВЛЕНИЕ Ткани внутренней среды Глава 1. Соединительная ткань.................................. 4 1.1. Химический состав и особенности обмена 1.1. Патология обмена соединительной ткани Глава 2. Скелетная ткань....................................... 10 2.1. Хрящевая ткань 2.2. Костная ткань 2.3. Остеогенез 2.4. Регуляция метаболизма и патология скелетных тканей 2.5. Зуб Глава 3. Мышечная ткань...................................... 18 3.1. Химический состав скелетной мышцы 3.2. Источники энергии мышечной деятельности 3.3. Сердечная мышца 3.4. Механизм мышечного сокращения 3.5. Классификация типов мышечных волокон и скелетных мышц 3.6. Патология мышечной ткани Глава 4. Нервная ткань...........................................29 Литература.....................................................33 Несмотря на все многообразие организации, а отсюда и физиологических свойств органов и систем, все они состоят из ограниченного числа тканей. Согласно современной классификации, предложенной фон Лейдигом, учитывающей особенности гистогенеза, выделяют 4 вида тканей: эпителиальную, мышечную, нервную и ткани внутренней среды. В данном пособии будут описаны химическое строение, функции и патология соединительной, скелетной, мышечной и нервной тканей. Ткани внутренней среды Общими чертами этой системы служат 1) мезенхимный генез; 2) большое количество межклеточного вещества; 3) крайнее разнообразие (соединительные, скелетные, ретикулярные, пигментная, жировая и др. ткани).
Глава 1. СОЕДИНИТЕЛЬНАЯ ТКАНЬ Рис. 1. Механизм посттрансляционной модификации цепей проколлагена.
Концевые участки отдельных про-α-цепей соединяются дисульфидными, а сами цепи - водородными связями. Накапливаясь в секреторных гранулах, молекулы проколлагена выделяются во внеклеточное пространство, где под действием проколлагеновых пептидаз отщепляются концевые пропептиды и образуется тропоколлаген. При последовательном объединении в цепь между хвостовым и головным концами соседних молекул тропоколлагена сохраняется зазор, а каждая цепь смещена относительно рядом лежащей на 1/4 ее длины. Так образуется фибрилла, имеющая поперечную исчерченность. Коллагеновое волокно формируется из многих параллельно связанных гликопротеинами коллагеновых фибрилл. Подобная суперспирализация обусловливает высокую механическую прочность волокна.
Особенно интенсивно идет синтез коллагена в заживающей ране, где образуется рубец, основным компонентом которого является данный белок. Описаны два пути распада коллагена: специфический и неспецифический. Первый осуществляется коллагеназой, которая гидролизует амидные связи, образованные между глицином и лейцином. Получившиеся пептидные фрагменты подвергаются действию других пептидгидролаз. Неспецифический распад коллагена провоцируется продуктами свободнорадикального окисления липидов, а заканчивается обычным протеолизом с участием тканевых протеаз. Маркером интенсивности катаболизма коллагена служит гидроксипролин, который в свободном виде затем транспортируется кровью, а частью выделяется с мочой. У взрослого человека с мочой экскретируется 15-50 мг данной аминокислоты в сутки, а в возрасте 10-20 лет этот показатель может достигать 200 мг. Второй вид волокон – эластические, включают эластин - гликопротеин с молекулярной массой 70 кД. Он, как и коллаген, содержит много глицина и пролина. С помощью лизина четыре пептидные цепи соединяются друг с другом (на месте химической стыковки четырех остатков лизина образуются десмозин и изодесмозин). В создании эластических структур также принимает участие фибриллины, которые формируют микрофибриллярный каркас – второй компонент эластического волокна, если первым считать аморфный эластин. Оба белка синтезируются в цистернах гранулярной эндоплазматической сети фибробластов, в комплексе Гольджи они упаковываются в секреторные гранулы, выделяемые во внеклеточную среду. Особая роль в посттрансляционной модификации принадлежит лизилоксидазе, с помощью которой путем окислительного дезаминирования ε-аминогруппы в остатках лизина, между четырьмя отдельными цепями формируются поперечные связи, обусловливающие образование резиноподобных структур, способных после деформации восстановить исходную форму.
Последний вид волокон – ретикулиновые – тонкие нити, состоящие из коллагена III типа, связанного с гликопротеинами и протеогликанами. Компоненты этих волокон синтезируются ретикулярными клетками, разновидностями фибробластов. Что касается клеточных элементов, входящих в состав соединительных тканей, к ним принадлежат фибробласты, макрофаги, лейкоциты, перициты, адипоциты, тучные клетки. Клеточные структуры занимают меньший объем, чем межклеточный матрикс в этих видах тканей. Функции, выполняемые этими клетками, самые разнообразные. Фибробласт – наиболее распространенный тип клеток, секретирует компоненты внеклеточного матрикса (коллаген, эластин, ГАГи, протеогликаны и др.), участник заживления ран. Особую роль в осуществлении защитной функции соединительными тканями играют макрофаги, которые способны секретировать более 60 биологически активных веществ. При фагоцитозе выделяется содержимое лизосом макрофагов, включающее активные формы кислорода (О2, ОН-, Н2О2), обладающие высокой антибактериальной способностью. В активированных макрофагах интенсивно осуществляется окисление арахидоновой кислоты с образованием простагландинов, лейкотриенов, тромбоксана. Кроме того, макрофаги – источники ферментов, разрушающих внеклеточный матрикс: эластазы, коллагеназы, протеиназы, гиалуронидазы. Эти клетки – профессиональные фагоциты. Они участвуют в заживлении ран, захватывают из крови денатурированные белки, обломки клеток, состарившиеся эритроциты, пылевые частицы; проявляют бактерицидную активность, запускают иммунные реакции. Тучные клетки участвуют в воспалительных и аллергических реакциях, они способны синтезировать биологически активные вещества (гистамин, гепарин, протеазы, кислые гидролазы, простагландины, лейкотриены и тромбоксаны). Содержание этих клеток в различных органах подвержено значительным индивидуальным и возрастным колебаниям. Последний фактор имеет значение и в целом для соединительно-тканных структур. По мере старения снижается тургор, образуются морщины и т. д. При этом регистрируется обеднение тканей ГАГами, а отсюда - водой с параллельным накоплением грубоволокнистых коллагеновых структур. По мнению части исследователей, в соединительных тканях заложена программа старения организма.
Глава 2. СКЕЛЕТНАЯ ТКАНЬ Опорно-двигательную функцию выполняет особый вид соединительной ткани, называемый скелетной. Она, в свою очередь, делится на хрящевую и костную. Первая - путем энхондрального остеогенеза формирует скелет у плода, в растущем организме, а при переломах костей служит местом образования костной ткани, ответственной за выполнение опорной функции.
Хрящевая ткань Хрящ (гиалиновый, эластический, волокнистый), как и другие варианты соединительной ткани, состоит из клеток (хондробластов _ хондроцитов) и межклеточного матрикса. Последний обеспечивает основные свойства – прочность и упругость ткани. В его составе содержится до 75% воды, что позволяет веществам из сосудов надхрящницы диффундировать в хрящевой матрикс (т.к. он не имеет кровеносных сосудов) и осуществлять питание хондроцитов. В межклеточном веществе наиболее значимы коллагены, протеогликаны и хондронектин. Среди первых преобладают II, VI, IX типы. С коллагеном типа X связывают способность некоторых хрящей к обызвествлению, поэтому, например, хрящи трахеи не содержат этой формы белка. В протеогликанах из ГАГов преобладают хондроитинсульфаты и гиалуроновая кислота. От гиалуроновой кислоты в разные стороны отходят полипептидные цепи, к глобулярной головке которых присоединены короткие молекулы олигосахаридов, а к противоположному концу белка – хондроитинсульфаты. По всей длине пептида прикреплены молекулы кератансульфата и олигосахарида. Главная функция протеогликанов – связывание воды в хрящевом матриксе. Чем длиннее фрагменты хондроитинсульфатов в составе протеогликана, тем больше жидкости включается в его молекулу. Из-за повреждения структуры хондроитинсульфатов снижается объем связанной воды, что характерно для лиц пожилого возраста, у которых при этом уменьшается упругость хряща.
Хондронектин – специфический белок, контролирует консистенцию матрикса, его мицеллы имеют площадки для связывания коллагена II типа, протеогликанов в плазмолемме хондроцитов. Основные клеточные элементы – хондроциты включают хорошо развитые гранулярную эндоплазматическую сеть и комплекс Гольджи. Многочисленные вакуоли содержат коллагены, протеогликаны, гликопротеины, секретируемые позднее в матрикс. Костная ткань Костная ткань имеет минерализованный матрикс, который состоит на 50 % из неорганической, на 25% из органической мастей, на воду же приходится оставшиеся 25%. Основными минеральными компонентами являются кальций (35%)и фосфаты (50%), входящие в состав кристаллов гидроксиапатита: Са10(РО4)6(ОН)2 {[Са3(РО4)2]3·Са (ОН)2}. Гидроксиапатиты соединяются с молекулами коллагена через остеонектин. Ионы кальция в решетке гидроксиапатита могут замещаться другими двухвалентными катионами. Кроме того, в межклеточное вещество входят бикарбонаты, фториды, ионы Мg, К, Nа и т.д. Своеобразной особенностью костного матрикса является высокая концентрация цитрата: около 90% его общего количества в организме приходится на долю этой ткани. Данные анионы необходимы для минерализации за сет образования комплексов с ионами кальция и фосфатами. В таком виде кальций легко перемещается в кость и обратно. Из-за относительно большого размера молекулы цитрат присоединяется к поверхности гидроксиапатита, не проникая вглубь кристалла. Кроме цитрата в матриксе регистрируются и другие органические ионы (сукцинат, фумарат, малат, лактат и др.).
Среди макромолекул межклеточного вещества преобладают коллаген, неколлагеновые белки и ГАГи ( хондроитинсульфат, кератансульфат), синтезированные и секретированные остеобластами. 90-95 % коллагена приходится на его I тип, в нем имеются фосфаты и дикарбоновые кислоты. Неколлагеновые протеины в основном обеспечивают регуляцию остеогенеза; к ним относят морфогены, митогены, факторы хемотаксиса и хемоаттракции. Как и большинство белков матрикса, морфогены принадлежат к гликопротеидам; они индуцируют дифференцировку полипотентных клеток в скелетогенные с образованием новой костной ткани (феномен остеоиндукции). Важнейший из них морфогенетический белок кости (МБК), состоящий из четырех субъединиц с общей молекулярной массой 75 500 Д. Под его влиянием остеогенез протекает по энхондральному типу, т.е. сначала образуется хрящ, а из него затем - кость. В 1983 году в США этот протеин получен в чистом виде и применяется при нарушенной регенерации кости. Митогены – сложные белки, в простетическую группу которых включены углеводы и фосфаты. Они действуют на преддифференцированные клетки, сохранившие способность к делению, увеличивая их способность к митозу. В основе их биохимического механизма действия лежит инициация репликации ДНК. К гликопротеидам принадлежат и факторы хемотаксиса и хемоаттракции, они определяют движение и прикрепление новообразованных структур под действием морфо- и митогенов. Наиболее известны: фибронектин, остеонектин и остеокальцин. Фибронектинсвязывает клетки и их неклеточные компоненты в единую систему. В молекуле этого протеина имеется центр для трансглутаминазы, которая катализирует взаимодействие между остатками глутамина и лизина в разных белках, соединяя их между собой. Так осуществляется сшивка молекул фибронектина друг с другом, коллагеном и другими неклеточными элементами матрикса или плазмолемм. Продукт остеобластов – остеонектин, - гликопротеид, обеспечивающий связывание минерального компонента с коллагеном. Остеокальцин – небольшойбелок в минерализованном матриксе кости, участвует в кальцификации, служит маркером для оценки активности костной ткани. Все вышеперечисленные неколлагеновые белки выполняют важную биологическую функцию, объединяя процессы деструкции и новообразования ткани. Разрушаясь, клетки выделяют их в среду, где, воздействуя на разные стадии дифференцировки, эти факторы индуцируют образование новых тканей. Среди клеточных компонентов выделяют 2 линии: созидающую и разрушающую. К первым принадлежат остеобласты и остеоциты, к последним – остеокласты.Остеобласты, как отмечено выше, синтезируют и секретируют вещества костного матрикса. В этих клетках регистрируется высокая активность щелочной фосфатазы, необходимой для минерализации межклеточных структур. Остеоциты – зрелые, неспособные к делению клетки, обеспечивают структурную целостность минерализованного матрикса, участвуют в регуляции обмена кальция в организме. Остеокласты выделяют большое количество протонов, что поддерживает кислую среду, оптимальную для растворения солей кальция костного матрикса. С помощью карбангидразы в клетках происходит следующая реакция:
в результате чего высвобождаются Н+; затем протонная Н+, К+-АТФ активно выкачивает их из остеокластов, закисляя ими замкнутое пространство лакуны. Кроме того, эти клетки секретируют кислые гидролазы, коллагеназы и другие литические ферменты, расщепляющие органическую часть костного матрикса.
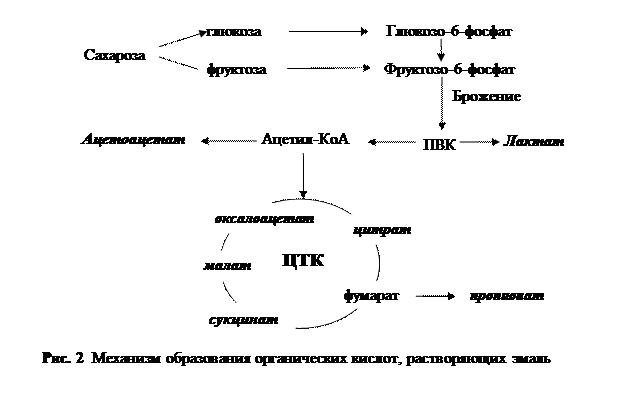
Остеогенез Начальная стадия формирования костной ткани обеспечивается активной работой специфической протеинкиназы, с помощью которой гидроксилсерин, включенный в коллаген, фосфорилируется за счет использования фосфата из АТФ. Затем к кислотному остатку присоединяется ион кальция, который поставляется цитратом; таков механизм образования первичных кристаллов гидроксиапатита. На их основе растут другие по типу эпитаксии (прорастание кристаллов без непосредственного взаимодействия с белком). Часть ионов кальция взаимодействует с анионами включенных в коллаген моноаминодикарбоновых кислот (глутамата и аспартата), в то время как содержащийся в нем лизин образует с неорганическим фосфатом фосфоамидную связь. Кроме того, в костной ткани преципитация кальция и фосфата возможна не только на белках, но и на углеводах и липидах. Сильно ионизированные кристаллы гидроксиапатита инициируют солидное электростатическое поле, которое, в свою очередь, удерживает вокруг них гидратную оболочку, играющую немаловажную роль в обмене ионами между кристаллами и межклеточной жидкостью. Зуб Зуб состоит из трех типов кальцифицированной ткани. Полость зуба заполнена пульпой, в ней находятся кровеносные сосуды и нервные окончания. Пульпа окружена дентином, основной кальцифицированной тканью. На выступающей части зуба дентин покрыт эмалью, погруженные в челюсть корни зуба - цементом. Зуб, как и кость, состоит из органического матрикса и минерализованных кристаллов гидроксиапатита. Межклеточное вещество дентина и цемента сходно с матриксом кости. Фибриллярные белки эмбриональной эмали очень богаты пролином и лизином. При формировании этой ткани сначала образуется белковый матрикс, который затем обызвествляется. В полностью созревшей эмали протеинов практически нет. Обновление фосфата в дентине происходит приблизительно в 6 раз медленнее, чем в эмали. Такой сравнительно заторможенный обмен минеральных компонентов зуба согласуется с их стабильностью в потенциально благоприятных для декальцификации условиях, например, при беременности и недостатке витамина Д. Самое распространенное заболевание: кариес - начинается с микроскопической деминерализации эмали, поверхность которой покрывает зубной налет, образующийся в результате осаждения микроорганизмов. Они разрушают легкоусвояемые углеводы до органических кислот (лактата, ацетоацетата, цитрата, сукцината, пропионата), образующих растворимые соли с катионами кальция, что провоцирует вымывание минеральных структур эмали.
Глава 3. МЫШЕЧНАЯ ТКАНЬ Мышечная ткань составляет 40-42% от массы тела. Ее биологическая функция – обеспечивать подвижность путем сокращения и последующего расслабления. При сокращении мышц осуществляется работа, связанная c превращением химической энергии в механическую. Различают два вида мышечных тканей: поперечно-полосатую (скелетную и сердечную) и гладкую. Процесс сокращения скелетной мышцы контролирует нервная система (соматическая двигательная иннервация). Сердечная и гладкая мышцы имеют вегетативную двигательную иннервацию. Скелетная мышца состоит изпучков вытянутых в длину клеток – мышечных волокон, обладающих тремя свойствами: возбудимостью, проводимостью и сократимостью. Отличительной чертой мышечных клеток от клеток, не обладающих свойством сократимости, является наличие саркоплазматического ретикулума. Он представляет собой замкнутую систему внутриклеточных трубочек и цистерн, окружающих каждую миофибриллу. Саркоплазматический ретикулум – модифицированная гладкая эндоплазматическая сеть, выполняющая функцию депо Са2+. Мышечные волокна имеют диаметр от 10 до 100 мкм и длину от 5 до 400 мм. В каждом мышечном волокне содержится до 1000 и более сократительных элементов миофибрилл. Сердечная мышца Сердечная мышца по содержанию ряда химических соединений занимает промежуточное положение между скелетной мускулатурой и гладкими мышцами. В миокарде и, особенно, в гладкой мускулатуре значительно меньше миофибриллярных белков, а концентрация протеинов стромы выше, чем в скелетной мышце. Известно, что миозин, тропомиозин и тропонин миокарда и гладкой мускулатуры заметно отличаются по своим физико-химическим свойствам от соответствующих белков скелетной мускулатуры. Содержание АТФ в сердечной выше, чем в гладкой и скелетной мускулатурах. По количеству гликогена миокард занимает промежуточное положение. Имеется определенная зависимость между характером деятельности мышц и содержанием фосфолипидов. Миокард по сравнению с другими мышечными тканями богаче этими соединениями, жирные кислоты которых, окисляясь, высвобождают значительную часть энергии, необходимой для сокращения миокарда. Особенности обмена веществ в миокарде заключаются в том, что основным энергосубстратом для него являются жирные кислоты. Они составляют примерно 70% от всех субстратов, использующихся для энергопродукции в сердечной мышце. Это объясняет высокую чувствительность миокарда к нехватке кислорода. В условиях гипоксии гликолиз с анаэробным окончанием не в состоянии обеспечить полноценную биоэнергетику сердечной мышцы, следствием чего является резкое снижение синтеза белков, обеспечивающих структурную организацию клеток.
3. 4. Механизм мышечного сокращения и расслабления (см. лекцию по физиологии).
Таблица 1. Патология мышечной ткани 1. Биохимические изменения при заболеваниях мышц (прогрессирующих мышечных дистрофиях, атрофии мышц в результате их денервации, тенотомии, полимиозита и т. д.): 1) снижение количества миофибриллярных белков, 2) увеличение концентрации протеинов стромы и некоторых саркоплазматических белков, 3) уменьшение величин АТФ и креатинфосфата, 4) падение АТФазной активности миозина, 5) изменения в фосфолипидном составе мышц: при росте значений сфингомиелина и лизофосфатидилхолина наблюдается снижение уровня фосфатидилхолина и фосфатидилэтаноламина, 6) нарушение метаболизма креатина (синтез креатинфосфата и образование креатинина), 7) рост активности АлАТ и АсАТ в сыворотке крови при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии. 2. Нарушение метаболизма сердечной мышцы при ишемической болезни сердца. При ишемии (нарушении кровоснабжения) повышаются концентрации катехоламинов (действуют через ц-АМФ), которые ускоряют анаэробные процессы гликогенолиза и гликолиза за счет имеющегося в сердечной мышце гликогена. Скоро его запасы истощаются, гликолиз замедляется вследствие внутриклеточного ацидоза, который ингибирует фосфофруктокиназу. Содержание АТФ и креатинфосфата снижается в результате угнетения окислительного фосфорилирования в митохондриях. Повреждение целостности мембран приводит к выходу ионов, в том числе калия. Дефицит энергоресурсов и изменение ионного баланса обусловливают торможение функциональной активности мышечных клеток и их постепенную гибель. Параллельно выявляются сдвиги во фракционном составе протеинов миокарда (резкое снижение содержания миофибриллярных белков и накопление протеинов стромы). Нарушение обменов углеводов, белков и липидов (свободные жирные кислоты не окисляются, а преимущественно включаются в триацилглицериды) при инфаркте миокарда находит отражение в жировой инфильтрации сердечной мышцы. В этих условиях активность АсАТ сыворотки крови резко возрастает (в 20-30 раз) уже через 3-5 часов после наступления инфаркта. Максимум активности АлАТ и АсАТ приходится на конец первых суток, а уже через 2-3 дня при благоприятном исходе болезни уровень сывороточных трансаминаз возвращается к норме. Напротив, при затяжном процессе или при наступлении повторного инфаркта миокарда регистрируется новый пик повышения активности этих ферментов. При различного рода коронарной недостаточности (стенокардия, пороки сердца и др., кроме инфаркта миокарда) гипертрансаминаземия либо не наблюдается, либо незначительна. Для своевременной диагностики инфаркта миокарда используют чаще определение активности креатинкиназы, аспартатаминотрансферазы, лактат- и α-гидроксибутиратдегидро-геназ в сыворотке крови (наиболее чувствительные тесты).
Глава 4. НЕРВНАЯ ТКАНЬ Нервная система уникальная биологическая структура, главное назначение которой управление функциями организма. Естественно, нейрохимия – самая сложная из областей современной биохимии. Основная структурно-функциональная единица – нейрон; число этих клеток составляет 1012-1015, они образуют сложные межнейрональные комплексы по функциональному принципу. Наряду с ними большую роль играют различные клетки нейроглии (астроциты, олигодендроциты, клетки эпендимы и микроглии), метаболически тесно связанные с нейронами. Сложнейшая система межнейрональных и периферических связей осуществляется через специфические образования – синапсы, обеспечивающие передачу и модуляцию сигнала с помощью химических и электрических механизмов. Характерная особенность нервной ткани – высокая интенсивность энергетического метаболизма. По потреблению кислорода и глюкозы мозг занимает первое место среди крупных органов человека. Причем глюкоза служит почти единственным субстратом окисления и не может быть заменена другими. Поскольку углеводные резервы мозга весьма незначительны, то эта ткань чрезмерно чувствительна к гипогликемии и гипоксии. На долю липидов приходится до 50% сухой массы нервной ткани, при этом фосфолипиды составляют около половины, а холестерол и гликолипиды примерно 25% от общего количества липидов. Для нервной ткани характерны специфические липиды: ганглиозиды, галактоцереброзиды, полифосфоинозитиды. Среди высших жирных кислот мозга преобладают пальмитат, стеарат, олеинат, арахидонат. Обращает на себя внимание высокое содержание ганглиозидов, особенно в мембранах нервных окончаний. Специфические липидные компоненты миелина – цереброзиды и сульфоцереброзиды, много в нем плазмалогенов. Гипоксия и чрезмерные функциональные нагрузки усиливают свободнорадикальное окисление липидов нейрональных мембран, что вызывает их повреждение, приводящее к выходу из клетки ионов, биологически активных веществ (медиаторов, пептидов, ферментов и др.). Одни из них (например, лизосомальные энзимы) вызывают альтерацию соседних клеток, другие (структурные белки) играют роль вторичных антигенов. При цитотоксическом повреждении значительно страдают окислительно-восстановительные процессы. Метаболизм аминокислот в нервной ткани имеет ряд специфических черт. Эти вещества широко используются для синтеза белков, пептидов, нейромедиаторов и других биологически активных веществ. Некоторые аминокислоты сами служат нейромедиаторами (глицин, глутаминовая кислота). Головной мозг характеризуется высокой концентрацией аминокислот глутаминовой группы. Глутамат, аспартат, N-ацетиласпартат, ГАМК составляют 75% пула свободных аминокислот. Эти соединения выполняют особую роль. Кроме нейромедиаторов, они могут служить источниками энергии, участвовать в обезвреживании аммиака. Вследствие высокой интенсивности этих процессов глутаминовая кислота, подвергаясь реакциям переаминирования, преобразуется в α-кетоглутарат – метаболит цикла трикарбоновых кислот. Или же работает известная цепь обезвреживания аммиака:
Соли глутамата используются в качестве пищевой приправы, но у некоторых лиц регистрируется повышенная чувствительность к нему (могут появиться ощущение жжения, напряжение мышц лица, боли в грудной клетке, голове, депрессия – эти симптомы известны как “синдром китайских ресторанов“, т.к. эта соль широко используется в китайской кухне). Многие аналоги глутамата токсичны. Ароматические аминокислоты имеют особое значение как предшественники катехоламинов и серотонина. В нервной ткани синтезируются различные белки, в том числе нейроспецифические, которые участвуют в генерации и проведении нервного импульса, процессах переработки и хранения информации, клеточном узнавании, рецепции и др.. Особую группу представляют сократительные белки нервной ткани (нейротубулин, нейростенин, актиноподобные белки – кинезин и др.), которые обеспечивают ориентацию и подвижность цитоструктурных образований (микротрубочек, нейрофиламентов), активный транспорт компонентов нейрона. Кроме того, в формировании миелина, в процессах клеточной адгезии, нейрорецепции участвуют специфические гликопротеиды. Передача сигнала в химическом синапсе осуществляется нейромедиаторами, которые представлены 4 группами: моноамины (серотонин, дофамин, гистамин, норадреналин), аминокислоты (медиаторы возбуждения: аспартат, глутамат; тормозные медиаторы: глицин, таурин, ГАМК), пуриновые (аденозин, АТФ), пептиды (нейропептид У, вещество Р, соматостатин, люлиберин). В механизмах формирования памяти участвуют как “классические” медиаторы, так и большое число нейропептидов; среди последних – вазопрессин, фрагменты АКТГ, введение которых в небольших дозах значительно стимулирует процессы, связанные с запоминанием и извлечением информации из памяти. Имеются сведения о том, что при обучении в мозге животных вырабатываются определенные олигопептиды, которые при введении необученным индивидам способны возбуждать у них выработку аналогичного навыка. Однако конкретные механизмы такого “транспорта памяти ” пока не известны. Гемато-энцефалический барьер (ГЭБ) (от греческого haimatos – кровь и enkephalos – мозг) – физиологический механизм, регулирующий обмен веществ между кровью, спино-мозговой жидкостью и мозгом. ГЭБ осуществляет защитную функцию, препятствуя проникновению в ЦНС некоторых ксенобиотиков, введенных в кровь, или продуктов нарушенного обмена веществ, образовавшихся в самом организме. От проницаемости ГЭБ в направлении кровь ® мозг и мозг ® кровь для различных веществ зависит в значительной степени состояние нервных клеток головного и спинного мозга, особо чувствительных даже к небольшим колебаниям состава и физико-химических свойств окружающей среды. Через различные участки ГЭБ из крови в ЦНС проникают те или иные соединения, необходимые для питания и деятельности нервных образований, различающихся как строением, так и химическим составом. В осуществлении барьерных функций особая роль межклеточному матриксу, находящемуся между клетками стенок капилляров, представленному протеогликанами.
ЛИТЕРАТУРА Березов Т.Т., Коровкин Б.Д. Биологическая химия М.: Медицина, 1998 – 708 с. Бохински Р. Современные воззрения в биохимии: Пер. с англ. – М.: Мир, 1987 – 854 с. Гистология (введение в патологию). Под ред. Э.Г. Улумбекова и Ю.А. Челогиева – М,: Медицина, 1997 – 947 с. Крю Ж. Биохимия. Медицинские и биологические факты М.: Мир, 1979 – 510 с. Ленинджер А. Основы биохимии (в 3- х томах). Пер. с англ. – М.: Мир, 1985 – 1018 с. Минченко Б.И., Беневолонский Д.С., Тищенина Р.С. Биохимические показатели нарушений в костной ткани. Часть I. Резорбция кости. / Клин. лаб. диагностика №1, 1999 г., - С. 8 – 16. Основы физиологии человека / под ред. Б.И. Ткаченко (в 2х томах). – Санкт-Петербург. Международный фонд истории науки. - 1994 – 980 с. Строев Е.А. Биологическая химия. М.: Высшая школа, 1986 – 479 с. Явербаум П.М., Васильев В.Г. Биохимия соединительной ткани, кости, зуба и слюны. – Иркутск: ИГМИ, 1992 – 29 с.
Компьютерная верстка: П.П. Терешков Ответственный за выпуск: А.Ц. Гомбоева БИОХИМИЯ ТКАНЕЙ Учебное пособие для преподавателей и студентов
ЧИТА 2000
Учебное пособие составлено доцентом кафедры биохимии А.Ц. Гомбоевой Под общей редакцией профессора кафедры биохимии ЧГМА Л.П. Никитиной
Рецензенты: зав. кафедрой биохимии профессор Л.П. Никитина, зав. кафедрой нормальной физиологии профессор Л.П. Малежик, зав. кафедрой гистологии доцент М.А. Джулай
Одобрено центральной методической комиссией Читинской государственной медицинской академии.
ОГЛАВЛЕНИЕ Ткани внутренней среды Глава 1. Соединительная ткань.................................. 4 1.1. Химический состав и особенности обмена 1.1. Патология обмена соединительной ткани Глава 2. Скелетная ткань....................................... 10 2.1. Хрящевая ткань 2.2. Костная ткань 2.3. Остеогенез 2.4. Регуляция метаболизма и патология скелетных тканей 2.5. Зуб Глава 3. Мышечная ткань...................................... 18 3.1. Химический состав скелетной мышцы 3.2. Источники энергии мышечной деятельности 3.3. Сердечная мышца 3.4. Механизм мышечного сокращения 3.5. Классификация типов мышечных волокон и скелетных мышц 3.6. Патология мышечной ткани Глава 4. Нервная ткань...........................................29 Литература.....................................................33 Несмотря на все многообразие организации, а отсюда и физиологических свойств органов и систем, все они состоят из ограниченного числа тканей. Согласно современной классификации, предложенной фон Лейдигом, учитывающей особенности гистогенеза, выделяют 4 вида тканей: эпителиальную, мышечную, нервную и ткани внутренней среды. В данном пособии будут описаны химическое строение, функции и патология соединительной, скелетной, мышечной и нервной тканей. Ткани внутренней среды Общими чертами этой системы служат 1) мезенхимный генез; 2) большое количество межклеточного вещества; 3) крайнее разнообразие (соединительные, скелетные, ретикулярные, пигментная, жировая и др. ткани).
Глава 1. СОЕДИНИТЕЛЬНАЯ ТКАНЬ Химический состав и особенности обмена Как отмечено выше, в состав всех волокнистыхсоединительных тканей входит, кроме клеток, значительный объем межклеточного матрикса, химический состав которого определяет физические свойства каждого типа ткани. Он состоит из основного вещества и погруженных в него волокон разливного типа. Основное вещество – аморфный, относительно прозрачный материал со свойствами геля включает гликозамингликаны, протеогликаны, гликопротеины. Их молекулы прочно связаны с волокнами матрикса. Гликозамингликаны (ГАГ) (гиалуроновая кислота, хондроитинсульфат, кератансульфат, дерматансульфат, гепарансульфат – вклад каждого вида ГАГов в разные варианты соединительных тканей специфичен; строение каждого смотри в учебнике) – это кислые полисахариды, построенные из повторяющихся дисахаридных единиц, одна из которых обычно уроновая кислота, а другая - аминосахар (N-ацетилглюкозамин, N-ацетилгалактозамин), часто сульфатированы. Из-за гидрофильности мицелл они способны связывать большое количество молекул воды и ионов (в частности, Na+), входящих во внеклеточную жидкость, образуя гель, через который диффундируют метаболиты. Протеогликаны – крупные макромолекулы, продукт связей ГАГов с белками, причем на долю первых приходится 90-95%. В гликопротеидах преобладает белковая компонента, соединенная с разветвленными углеводами (могут включать галактозу, маннозу, рамнозу и сиаловые кислоты). Эти сложные белки связывают клетки с внеклеточным матриксом, входят в фибриллярные структуры. Среди последних выделяют фибронектин и фибриллин. Фибронектин включает две одинаковые полипептидные цепи, соединенные двумя бисульфидными мостиками. Этот белок участвует в адгезии клеток, контролирует их морфологию и архитектуру поверхности, а также формирует фибриллы межклеточного матрикса, образуя связи с коллагеном и ГАГами. Так устанавливается структурная непрерывность между цитоскелетом и внеклеточным матриксом. За функционирование фибронектина ответственны SH-группы, при их блокировании свойства белка теряются. Другой белок – фибриллин входит в состав эластичных структур, обеспечивая их упорядоченное строение, усиливая связи между внеклеточными компонентами. Что касается волокон межклеточного вещества, различают коллагеновые, эластические, ретикулиновые. В большинстве тканей присутствуют коллагеновые волокна, основу которых составляет коллаген. Его молекула – спираль из трех про-α-цепей, каждая из которых включает около 1000 аминокислотных остатков, среди которых преобладают глицин (23%), пролин и гидроксипролин (на обе приходится 18%), лизин. Описано 13 типов коллагенов, чаще всего встречаю
|
||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 448; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.43.200 (0.017 с.) |