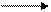Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химический состав скелетной мышцыСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
В мышечной ткани содержится от 72 до 80% воды. Около 20-28% от массы мышцы приходится на долю сухого остатка, главным образом, белков. Оставшуюся часть составляют гликоген и другие углеводы, различные липиды, экстрактивные азотсодержащие вещества, соли органических и неорганических кислот и другие химические соединения. Белки мышечной ткани делят на три группы: миофибриллярные и саркоплазматические протеины, белки стромы. На долю первых приходится около 45%, вторых - 35% и третьих – 20% всего мышечного белка. Эти группы полипептидов резко отливаются друг от друга по растворимости в воде и солевых растворах с различной ионной силой. К миофибриллярным белкам относятся миозин, актин, актомиозин и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц. Миозин составляет 50-55% от сухой массы миофибрилл. Его молекулярная масса около 460 000Д. Молекула миозина имеет сильно вытянутую форму длиной 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи с молекулярной массой 205 000 - 210 000Д и несколько коротких цепей, относительная масса которых составляет около 20 000Д. Тяжелые цепи образуют длинную закрученную α-спираль (²хвост² молекулы), конец которой совместно с легкими цепями создает глобулу (²головку² молекулы), способную соединяться с F-актином. Эти головки выдаются из основного стержня молекулы. Миозин обладает АТФ-азной активностью. Актин составляет ~20% от сухой массы миофибрилл. Молекулы глобулярного актина (G-актин) (М.м. 42000Д), состоящие из одной полипептидной цепочки, полимеризуясь, образуют фибриллярный актин (F-актин). В мышечных клетках весь актин находится в F-форме. К нему могут присоединяться головки миозина, причем в фибриллярном актине на каждой глобуле G-актина есть центр связывания миозина. Соединение F-актина с миозином называют актомиозином. На долю тропомиозина приходится около 4-7% всех белков миофибрилл, молекулярная масса не превышает 65 000Д. Его молекула состоит из двух?-спиралей. Данный белок располагается вблизи желобков спиральной ленты F-актина, вдоль нее, причем каждая молекула тропомиозина соединена с семью молекулами G-актина, а концами примыкает к таким же соседним молекулам. Тропонин – глобулярный белок с молекулярной массой 80 000Д. Он построен из трех разных субъединиц (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может угнетать АТФ-азную активность, Тн-С (кальцийсвязывающий) обладает значительном сродством к ионам кальция, Тн-Т (тропомиозинсвязывающий) обеспечивает связь с тропомиозином. Образовавшийся комплекс, названный нативным тропомиозином, прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам кальция. К саркоплазмати ческим белкам относятся миоглобин, Са2+-транспортирующие АТФазы, Са2+-связывающий белок – кальсеквестрин, белки – ферменты. Миоглобин –протеид, простетической группой которого служит гем (М.м 16700Д). Он связывает молекулярный кислород и передает его окислительным системам клеток; также обеспечивает мышцы некоторым запасом этого газа. Са2+-транспортирующие АТФазы саркоплазматического ретикулума откачивают ионы кальция из сарколеммы (при расслаблении). Са2+-связывающий белок – кальсеквестрин находится внутри саркоплазматической сети. В мышечных волокнах содержатся белки – ферменты, катализирующие процессы гликолиза, биологического окисления, окислительного фосфорилирования, а также многие стороны азотистого и липидного обменов. Сведения о белках стромы: коллагене и эластине подробно рассмотрены в главе ’’Соединительная ткань’’. Небелковые азотсодержащие соединения скелетных мышц: адениловые нуклеотиды (АТФ, АДФ и АМФ), нуклеотиды неаденилового ряда, креатинфосфат, креатин, креатинин, карнозин, анзерин, свободные аминокислоты и др. Креатин и креатинфосфат участвуют в химических процессах, связанных с мышечным сокращением. Креатин синтезируется в печени из аргинина, глицина и метионина. Оттуда с током крови он поступает в мышечную ткань, где фосфорилируясь, превращается в креатинфосфат. К числу азотистых веществ мышечной ткани принадлежат имидазолсодержащие дипептиды – карнозин и анзерин, которые увеличивают амплитуду мышечного сокращения, предварительно сниженную утомлением (повышают эффективность работы ионных насосов). Эти соединения, являясь антиоксидантами, выполняют защитную функцию в данной ткани. Среди свободных аминокислот в мышцах наиболее высокую концентрацию имеет глутаминовая кислота (до 1,2 г/кг) и ее амид – глутамин (0,8-1,0 г/кг). Другие азотсодержащие вещества: мочевина, мочевая кислота, аденин, гуанин, ксантин и гипоксантин встречаются в небольшом количестве и, как правило, являются либо промежуточными, либо конечными продуктами азотистого обмена. Липиды. В состав различных клеточных мембран мышечной ткани входит ряд глицерофосфатидов: фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и др. Углеводы. Гликоген запасается в саркоплазме в виде включений. Его концентрация колеблется от 0,3% до 2% и выше. Гликоген выполняет энергетическую функцию в мышечной ткани, где находят лишь следы свободной глюкозы и очень мало гексозофосфатов. В процессе метаболизма глюкозы, а также аминокислот в мышечной ткани образуются молочная, пировиноградная кислоты. Состав неорганических солей разнообразен. Среди катионов наибольшую концентрацию имеют калий и натрий. Ионы первого сосредоточены внутри мышечных волокон, а натрия – в межклеточном матриксе. Значительно меньше в мышцах магния, кальция и железа. Также содержится ряд микроэлементов: кобальт, селен, алюминий, никель, бор и т.д.
3.2.Источники энергии мышечной деятельности Процессом, непосредственно связанным с работающим механизмом поперечнополосатого мышечного волокна, является распад АТФ, постоянный ресинтез которого обеспечивается следующими процессами. Ресинтез АТФ из АДФ и креатинфосфата, катализируемый креатинкиназой, быстрый путь образования АТФ во время сокращения мышц (частный вид субстратного фосфорилирования).
Окислительное фосфорилирование. Восстановительные потенциалы, образующиеся в процессахаэробного окисления углеводов, также при окислении жирных кислот и кетоновых тел, включаются в биологическое окисление, выделившаяся при этом энергия используется для синтеза АТФ из АДФ и неорганического фосфата.
Трансфосфорилирование. Некоторое количество АТФ может ресинтезироваться в ходе аденилаткиназной (миокиназной) реакции:
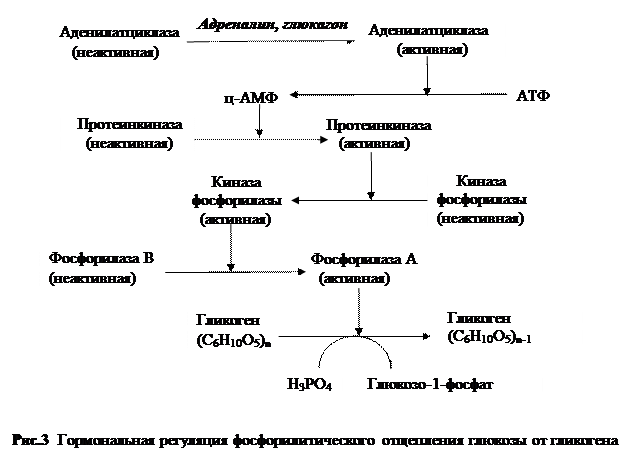
Мышечные волокна используют окислительный либо гликолитический путь синтеза АТФ. В ходе аэробного окисления из одной молекулы глюкозы образуются 38 молекул АТФ и конечные продукты метаболизма – вода и углекислый газ (красные волокна), а при анаэробном типе метаболизма путем субстратного фосфорилирования синтезируются 2 молекулы АТФ, а также молочная кислота (белые волокна). При переходе от состояния покоя к интенсивной мышечной работе потребность скелетных мышц в энергии за короткое время (доли секунды) возрастает в сотни раз. Каскадный механизм (рис. 3) обеспечивает интенсивный распад больших количеств глюкозы за короткое время. Процесс начинается вне организма с возникновения стрессовой ситуации, связанной с необходимостью напряженной работы, например, в спортивных состязаниях, при бегстве от опасности и т.п. В ответ на сигнал центральной нервной системы из мозгового вещества надпочечников выходит в кровь адреналин, который взаимодействует с рецепторами мембран мышечных клеток и запускает каскад реакций. Когда необходимость в мышечной работе отпадает, усиленная секреция адреналина прекращается. Уже выделившийся гормон разрушается, в результате этого инактивируется аденилатциклаза. Имеющийся в клетке ц-АМФ инактивируется фосфодиэстеразой, следовательно, модифицируются протеинкиназы; фосфорилаза и синтаза гликогена дефосфорилируются фосфатазами, и система приходит в состояние, когда мобилизация полисахарида подавлена, но возможен его синтез. Влияние адреналина на работоспособность связано не только с использованием гликогена, он также стимулирует мобилизацию жиров, действуя через ряд реакций, включающий синтез ц-АМФ, активацию протеинкиназы и фосфорилирование липазы. Кроме того, адреналин повышает частоту и силу сокращений миокарда, а значит, и скорость кровотока. В результате увеличивается доставка в мышцы кислорода, а также глюкозы и других веществ, служащих источниками энергии.
Существует еще один механизм ускорения использования гликогена при мышечной работе. Киназа фосфорилазы – Са-зависимый фермент. В состоянии покоя концентрация кальция в саркоплазме очень низка и киназа фосфорилазы практически неактивна. При поступлении нервного импульса ионы Са2+ из цистерн саркоплазматического ретикулума переходят в саркоплазму, активируя фермент. Каскадный механизм в мышцах функционирует лишь при необходимости интенсивной и срочной работы. При умеренных нагрузках практически нет фосфорилазы а, но распад гликогена тем не менее происходит. Это связано с тем, что фосфорилаза б может активироваться иным способом. В работающих мышцах в результате распада АТФ повышается концентрация Н3РО4. Кроме того, под действием повышается уровень АМФ:
АМФ и Н3РО4 являются аллостерическими активаторами фосфорилазы в. Последняяобеспечивает скорость мобилизации гликогена, достаточную для выполнения умеренной физической работы. Кроме того, АМФ инактивирует фосфофруктокиназу – ключевой фермент гликолиза. Этот механизм играет основную роль в ускорении гликолиза при сокращении мышц. В интенсивно работающих скелетных мышцах мощность механизма транспорта кислорода к митохондриям и аппарата синтеза АТФ оказываются недостаточными для обеспечения всей энергетической потребности; в этих условиях резко увеличивается субстратное фосфорилирование АТФ, в мышцах накапливается молочная кислота. После тяжелой мышечной работы концентрация лактата в крови может достигнуть 20 ммоль/л (при норме 1-2 ммоль/л). Особенно велико значение анаэробного гликолиза при кратковременной интенсивной работе. Молочная кислота раздражает нервные окончания, что вызывает своеобразные боли (например, после выполнения необычной физической нагрузки). Тучные клетки в ответ на накопление лактата вырабатывают гистамин (медиатор боли); последний, в свою очередь, усиливает кровоснабжение мышц. Молочная кислота поступает в кровь и улавливается печенью, где и превращается в пируват, который частично окисляется, частично вступает в глюконеогенез (рис. 4).
При длительной физической нагрузке анаэробные процессы переключаются на аэробные. В этих условиях в большей степени в качестве энергосубстрата используется не глюкоза, а высшие жирные кислоты. Около 70% кислорода, поглощаемого сердечной мышцей, расходуется для распада ВЖК. Образованный в β-окислении ацетил-КоА используется для синтеза кетоновых тел; содержание последних в крови склонно возрастать при длительной мышечной работе. При сокращении наряду с молочной кислотой в кровь выделяются значительные количества аланина. Это соединение образуется в мышце из пировиноградной кислоты путем трансаминирования. Из кровотока аланин поглощается печенью, где в результате переаминирования вновь превращается в пируват, который используется для глюконеогенеза (глюкозаланиновый цикл). Таким способом осуществляется перенос из мышц в печень не только пирувата, но и аминокислоты. Сердечная мышца Сердечная мышца по содержанию ряда химических соединений занимает промежуточное положение между скелетной мускулатурой и гладкими мышцами. В миокарде и, особенно, в гладкой мускулатуре значительно меньше миофибриллярных белков, а концентрация протеинов стромы выше, чем в скелетной мышце. Известно, что миозин, тропомиозин и тропонин миокарда и гладкой мускулатуры заметно отличаются по своим физико-химическим свойствам от соответствующих белков скелетной мускулатуры. Содержание АТФ в сердечной выше, чем в гладкой и скелетной мускулатурах. По количеству гликогена миокард занимает промежуточное положение. Имеется определенная зависимость между характером деятельности мышц и содержанием фосфолипидов. Миокард по сравнению с другими мышечными тканями богаче этими соединениями, жирные кислоты которых, окисляясь, высвобождают значительную часть энергии, необходимой для сокращения миокарда. Особенности обмена веществ в миокарде заключаются в том, что основным энергосубстратом для него являются жирные кислоты. Они составляют примерно 70% от всех субстратов, использующихся для энергопродукции в сердечной мышце. Это объясняет высокую чувствительность миокарда к нехватке кислорода. В условиях гипоксии гликолиз с анаэробным окончанием не в состоянии обеспечить полноценную биоэнергетику сердечной мышцы, следствием чего является резкое снижение синтеза белков, обеспечивающих структурную организацию клеток.
3. 4. Механизм мышечного сокращения и расслабления (см. лекцию по физиологии).
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 640; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.134.106 (0.01 с.) |