Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Алгоритм внутриаптечного контроля тритурации димедрола 1:10Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
• Работа с рецептом не проводится • Письменный контроль Проверить запись в книге учета лабораторных и фасовочных работ. Димедрол — 1,0 Сахар молочный — 9.0 m общая =10,0 7 Поставить № анализа: Подпись провизора-аналитика: • Органолептический контроль Белый однородный сыпучий порошок. • Физический контроль не проводится.
• Химический контроль По приказу М3 РФ № 214 от 16.07.97 тритурации подлежат полному химическому контролю обязательно. Качественный контроль: • на основание димедрола (реакция образования оксониевой соли); • на сахар (с раствором нитрата кобальта). Количественное определение: метод нейтрализации в спирто-хлоро- формной среде m димедрола = 1,0 доп.отк = ± 5% • Оформление результатов анализа: • заполнить «Журнал регистрации результатов органолептического, физического и химического контроля внутриаптечной заготовки, лекарственных форм, изготовленных по индивидуальным рецептам (требованиям лечебных учреждений), концентратов, полуфабрикатов, тритураций, спирта этилового и фасовки»; • поставить номер анализа и подпись в книге учета лабораторнофасовочных работ и на этикетке. • Контроль при отпуске - больным не отпускают. Контроль состоит в проверке правильности оформления штангласа для ассистентской. На штангласе должна быть четкая и полная надпись: TrituratioDimedrolicumSaccharolactatis1:10 1 часть Dimedroli+ 9 частей Saccharilactatis 0,01 г Dimedroli= 0,1 г TriturationisДата: Приготовил: Проверил: № анализа: Хранят тритурацию димедрола в сухом, защищенном от света месте.
ЗАНЯТИЕ 4 ВНУТРИАПТЕЧНЫЙ КОНТРОЛЬ СЛОЖНЫХ ДОЗИРОВАННЫХ ПОРОШКОВ АСКОРБИНОВОЙ КИСЛОТЫ И глюкозы Задачи • Освоить внутриаптечный контроль сложных дозированных порошков. • Научиться проводить химический контроль сложной лекарственной формы с учетом влияния ее компонентов на анализ друг друга. • Совершенствовать навыки проведения необходимых расчетов и оформления результатов анализа. Продолжительность занятия 2 академических часа (90 минут) Вопросы для самоподготовки • Составьте алгоритм внутриаптечного контроля сложных дозированных порошков аскорбиновой кислоты и глюкозы. • Влияют ли компоненты смеси на качественный анализ друг друга? Назовите фактор влияния. Какой прием используют при идентификации глюкозы? • Влияют ли компоненты смеси на количественный анализ друг друга? Приведите методики количественного определения аскорбиновой кислоты и глюкозы при их совместном присутствии. • Расчеты содержания действующих веществ, титра, ориентировочного объема титранта. Оформление результатов контроля. Материальное обеспечение Реактивы: • кислота хлористоводородная, кислота серная разведенная; • кислота серная концентрированная; • жидкость Фелинга; тимол (кристаллический).
Титрованные растворы и индикаторы: • 0,1 моль/л раствор иода; • 0,1 моль/л раствор натрия гидроксида; • 0,1 моль/л раствор натрия тиосульфата; • раствор крахмала; • фенолфталеин. Посуда, приборы, оборудование: • титровальная установка; • рефрактометр; • ручные весочки и разновес; • склянки с притертой пробкой; • цилиндры на 10 мл; • пробирки; • фарфоровая чашка; • глазные пипетки; • вага. Rp: Acidi ascorbinici 0,1 Glucosi 0,4 Misce fiat pulvis. Da tales doses № 10 S. По одному порошку 3 раза в день. Свойства Белый сыпучий однородный порошок, без запаха, сладковато-кислого вкуса. Растворим в воде. Подлинность • На аскорбиновую кислоту • у-лактон-2,3-дегидро- L-гулоновой кислоты
Реакции подлинности на аскорбиновую кислоту основаны на ее сильно выраженных восстановительных свойствах. При этом енольная форма окисляется и переходит в кетонную (процесс сопровождается подкислением | о | С -- ОН = C = О || | + 2Н+ С -- ОН С = О | | енольная форма кетоформа аскорбиновая кислота дегидроаскорбиновая кислота а) реакция с раствором нитрата серебра 0,01 г порошка растворяют в 0,5 мл воды и прибавляют 2 капли раствора нитрата серебра. Выпадает черный осадок. | | С -- ОН C = O || +2Ag NO3 = | + 2HNO3 + 2 Ag С -- ОН C = O | |
б) реакция с реактивом Фелинга 0,01 г препарата нагревают с реактивом Фелинга. Наблюдают выделение кирпично-красного осадка. | | C – OH C = O || + 2Cu(OH)2 = Сu2O + | + H2O C – OH C = O | |
в) реакция с хлоридом окисного железа и феррицианидом калия К раствору препарата прибавляют 1-2 капли раствора хлорида окисного железа. Происходит восстановление железа (III) до железа (II). | | C - OH C = O || + 2FeCI3 = | + 2FeCI2 + 2HCI C - OH C = O | |
После прибавления к раствору одной капли раствора феррицианида калия появляется синее окрашивание (образование турнбулевой сини) 3FeCl2 + 2K3[Fe(CN)6] -> 6КС1 + Fe3[Fe(CN)6]2
• На глюкозу С6H12O6 а) реакция на глюкозу также основана на восстановительной способности. Но глюкоза более слабый восстановитель. Аскорбиновая кислота мешает определению глюкозы, поэтому для идентификации глюкозы необходимо предварительно окислить аскорбиновую кислоту. С этой целью 0,05 г препарата растворяют в 1 мл воды, добавляют 5 капель пергидроля и кипятят 2-3 минуты. В этих условиях енольная форма аскорбиновой кислоты окисляется до кетоформ | о | С -- ОН = C = О || | + 2Н+ С -- ОН С = О | |
Для нейтрализации продуктов реакции добавляют 2-3 капли раствора аммиака. Затем проводят качественную реакцию на глюкозу с реактивом Фелинга. Раствор кипятят с 0,5 мл реактива Фелинга. Наблюдают образование кирпично-красною окрашивания. C6H12O6 + 2Cu(OH)2 -> Си20! + C6H12O7 + 2Н20 кир-кр
б) реакция с тимолом в среде концентрированной серной кислоты К 0,01 г порошка прибавляют 0,01 г тимола, 5-6 капель концентрированной серной кислоты, 1-2 капли воды. Появляется темно-красное окрашивание. Этой реакции на глюкозу не мешает присутствие аскорбиновой кислоты.
Количественное определение Количественное определение компонентов проводят ступенчато в одной навеске, использую их разную восстановительную способность. Аскорбиновая кислота как наиболее сильный восстановитель может окисляться даже таким слабым окислителем, как 0,1 моль/л раствор иода. При этом енольная форма аскорбиновой кислоты переходит в кетонную без разрыва лактонного кольца. Количественное определение аскорбиновой кислоты проводят методом иодометрии (прямое титрование). Глюкоза в этих условиях не титруется (не окисляется). После снятия точки эквивалентности для аскорбиновой кислоты меняют условия титрования. Теперь окислителем выступает иод в щелочной среде. Образующийся гипоиодит натрия (сильный окислитель) способен окислить и глюкозу. Для титрования глюкозы используют метод иодометрии в щелочной среде (обратное титрование). • Количественное определение аскорбиновой кислоты МетиО иодометрии (прямое титрование) 0,1 г порошка растворяют в 10 мл воды в склянке с притертой пробкой (почему?) и титруют 0,1 моль/л раствором иода до желтого окрашивания без индикатора (почему?). Записать количество мл 0,1 моль/л раствора J2, ушедших на титрование | | C-OH C=O || + I2 = || + 2HI C-OH C=O | |
М аскорбиновой к-ты= 176,13 г/ моль f= 1/2 T = M* f * cf = 176 *1|2 * 0,1 = 0,0088 г/мл 1000 1000
Vориентир.= m = 0,02 = 2,27 мл (в одной дозе 0,5 г содержится 0.1г аскорбиновой кислоты, а в Т 0,0088 0,1 г порошка Х г аскорбиновой кислоты. Х = 0,1 * 0,1 =0,02 - столько содержится аскорбин. 0,5 кислоты во взятой на титрование навеске. m аскорб. к-ты = V*K * T* A навеска, где А - масса одного порошка (0,5г) допустимые нормы отклонения =? (таблица 4) • Количественное определение глюкозы Метод иодометрии в щелочной среде (обратное титрование) К выше оттитрованному раствору прибавляют по бюретке 20 мл 0.1 моль/л раствора иода, 10-15 мл 1% или 30 40 мл 0,1 моль/л раствора гидроксида натрия, оставляют стоять в темном месте 15 минут. При этом глюкоза окисляется до глюконовой кислоты. I2 + 2NaOH=NaIO+H2O + NaI R-COH + NaOI + NaOH = R-COONa + NaI +H2O
Затем прибавляют 10 мл разведенной серной кислоты и выделившийся иод оттитровывают 0,1 моль/л раствором тиосульфата натрия. Титрование ведут сначала до соломенно-желтого окрашивания, затем добавляют 8-10 капель крахмала и продолжают титровать до обесцвечивания. NaI + NaIO +H2SO4= I2 + Na2SO4 + H2O I2 + Na2S2O3 = 2NaI + Na2S4O6. 1 мл 0,1 моль/л раствора иода соответствует 0,0099 г глюкозы.
mглюкозы = (V1*K -V2*K) * T * A навеска
Вариант № 2 • Количественное определение аскорбиновой кислоты \ Метод нейтрализации 0,05 г порошка растворяют в 2 мл воды и титруют 0,1 моль/л раство- | | C-OH C-OH || + NaOH = || + H2O C-OH C-ONa Маскорбин. к-ты =176,13 г/моль f аскорб. к-ты = 1 % аск. К-7Ы
г глюк
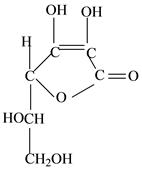
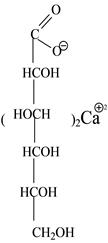
ЗАНЯТИЕ 5 КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ (СОЛИ, ЛАКТОНЫ). АМИНОКИСЛОТЫ. ВНУТРИАПТЕЧНЫЙ КОНТРОЛЬ ВНУТРИАПТЕЧНОЙ ЗАГОТОВКИ РАСТВОРА КАЛЬЦИЯ ГЛЮКОНАТА 5% — 100 МЛ № 30 Задачи • Коррекция и совершенствование знаний по теме «Карбоновые кислоты и их производные (соли, лактоны). Аминокислоты». • Совершенствование знаний, умений и навыков проведения внутри- антечного контроля внутриаптечной заготовки. • Освоить химический контроль кальция глюконата. Продолжительность занятия 2 академических часа (90 минут) Вопросы для самоподготовки • Связь между химическим строением карбоновых кислот, аминокислот и их действием на организм. Русские, латинские, химические названия, способы получения, подлинность, испытания на чистоту, количественное определение, применение, хранение и отпуск лекарственных препаратов: натрия цитрата для инъекций, натрия гидроцитрата для инъекций, кальция глюконата, кислоты аскорбиновой, кислоты глютаминовой, кислоты аминокапроновой. • Особенности внутриаптечного контроля внутриаптечной заготовки. Составьте алгоритм внутриаптечного контроля внутриаптечной заготовки и фасовки раствора кальция глюконата 5% — 100 мл № 30. • Химический контроль внутриаптечной заготовки раствора кальция глюконата. Особенности расчетов. Оформление результатов контроля. Материальное обеспечение Реактивы: • раствор оксалата аммония; • раствор трихлорида железа; • аммиачный буферный раствор. Титрованные растворы и индикаторы: • 0.05М раствор трилона Б; • раствор кислотного хром темно-синего. Посуда, приборы, оборудование: • титровальная установка; • рефрактометр; • набор глазных пипеток; • колба для титрования; • мерный цилиндр на 10 мл; • часовое (предметное) стекло; • пробирки; • вата; • пипетка 1 мл. Solutio Calcii gluconatis 5% — 100 ml № 30
Свойства Бесцветная прозрачная жидкость без запаха и вкуса, нейтральной реакции среды. Подлинность • На Са2+ К 3-5 каплям раствора на часовом стекле прибавляют 1-2 капли раствора оксалата аммония. Наблюдают белый осадок, растворимый в минеральных кислотах и нерастворимый в уксусной кислоте и растворе аммиака. Са2+ + (NH4)2C2O4 = CaC2O4 + 2NH4+ • На глюконат-ион К 3-5 каплям раствора прибавляют 2 капли раствора хлорида окисного железа. Наблюдают светло-желтое окрашивание.
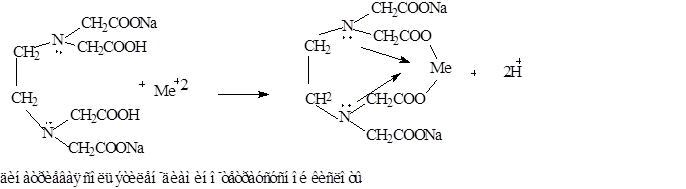
Количественное определение • Метод комплексонометрии (тржонометрии) К 1 мл препарата добавляют 5 мл аммиачного буферного раствора, 5 - 7 капель индикатора кислотного хром темно-синего и титруют 0,05 М раствором трилона Б до перехода ало-красного окрашивания в сине-фиолетовый цвет.
1 мл 0,05 М раствора трилона Б соответствует 0,02242 г глюконата кальция. m = V • К • Т * 3000 навеска доп.отк = ±3%!
Vориент= m = 0,05 =1,19 мл 0,05 г глюконата кальция, которая содержится в 1 мл T 0,02242 анализ. р-ра
• Рефрактометрический метод С% = п - п„ F F 5%ppa = 0,00166 доп. отк. =±4%! АЛГОРИТМ ВНУТРИАПТЕЧНОГО КОНТРОЛЯ ВНУТРИАПТЕЧНОЙ ЗАГОТОВКИ И ФАСОВКИ РАСТВОРА КАЛЬЦИЯ ГЛЮКОНАТА 5% — 100 МЛ № 30 • Письменный контроль Проверяется запись в книге учета лабораторных и фасовочных работ: Кальция глюконата 150,0 КУО = 0,5 Воды очищенной 2925 мл V общ = 3000 мл
Раствор кальция глюконата 5% — 100 мл № 30 Поставить: № анализа: Подпись провизора-аналитика:
• Органолептический контроль Бесцветная прозрачная жидкость без механических включений. • Физический контроль Количество флаконов — 30. Проверка качества укупорки. V фасовки = 100 мл дои.откл = ± 3% Проверяется не менее 3 флаконов от данной серии внутриаптечной заготовки. • Химический контроль По приказу М3 РФ № 214 от 16.07.97, внутриаптечная заготовка (каждая серия) подлежит полному химическому контролю обязательно. Качественный анализ. Доказательство Са2+ и глюконат-иона Количественный анализ: • метод комплексонометрии (масса глюконата кальция рассчитывается на весь приготовленный объем внутриаптечной заготовки); • метод рефрактометрии (определяется процентное содержание) • Оформление результатов анализа: • заполнить «Журнал регистрации результатов органолептического, физического и химического контроля внутриаптечной заготовки, лекарственных форм, изготовленных по индивидуальным рецептам (требованиям лечебных учреждений), концентратов, полуфабрикатов, тритураций, спирта этилового и фасовки»; • в книге учета лабораторных и фасовочных работ поставить номер анализа и подпись провизора-аналитика. • Оформление к отпуску Проверить этикетку: «Внутреннее». Предупредительная надпись «Беречь от детей». Раствор кальция глюконата 5% — 100 мл. На этикетке указаны номер и местонахождение аптечного учреждения, а также серия, срок годности, дата, цена. ЗАНЯТИЕ 6
|
||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 4562; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.222.132 (0.011 с.) |