
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет ЭДС гальванического элементаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. ЭДС = ЕК – ЕА. Если условия стандартные, то ЭДС элемента Даниэля –Якоби будет равным + 1,18 В. ЭДС = 0,34 –(–0,76) =1,18. Если условия отличаются от стандартных, то пользуются эмпирической формулой Нернста для расчета электродных потенциалов:
где
n – степень окисления металла; R – универсальная газовая постоянная, R = 8,31 Дж/моль К; F – число Фарадея, F = 96500 Кл; [Men+] – концентрация ионов металла в растворе, моль/л.
Если подставить в данную формулу значения R, F, T = 298 K и перевести натуральный логарифм в десятичный, то получится упрощенная формула Нернста:
Таблица 6 – Стандартные электродные потенциалы
Примеры решения задач: Задача 1. Вычислите ЭДС гальванического элемента, состоящего из двух электродов: Ti | Ti2+ (0,01 моль/л) || Ni2+ (1 моль/л) | Ni. Решение: ЭДС гальванического элемента можно рассчитать как разность потенциалов: ЭДС = EК – ЕА В данном гальваническом элементе катод - Ni° |Ni2+, а анод - Ti°|Ti2+. Схема гальванического элемента: А (–) Ti | Ti2+ || Ni2+ | Ni (+) К Процессы на электродах: (–) А: Ti – 2e- = Ti2+; (+) K: Ni2+ + 2e- = Ni. По формуле Нернста рассчитываем значение электродного потенциала анода. E Ti/Ti2+ = E0 T/|Ti2+ + Значение электродного потенциала катода равно величине стандартного электродного потенциала никелевого электрода, так как концентрация ионов Ni2+ в растворе составляет 1 моль/л. E Ni/Ni2+ = E0 Ni/Ni2+ = – 0,250 В; ЭДС = –0,250 – (–1,689) = 1,439 В. Задача 2. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного оловянным и стандартным водородным электродами, если концентрация соли олова равна 0,01 моль/л.
Решение: ЭДС гальванического элемента можно рассчитать как разность потенциалов: ЭДС = EК – ЕА В данном гальваническом элементе катод – стандартный водородный электрод, а анод - Sn|Sn2+. Схема гальванического элемента: А (–) Sn | Sn2+ || 2H+ | H2 (Pt) (+) К Процессы на электродах: (–) А: Sn – 2e- = Sn2+; (+) K: 2H+ + 2e- = H2 По формуле Нернста рассчитываем значение электродного потенциала анода. E Sn/Sn2+ = E0 Sn/|Sn2+ + Значение электродного потенциала катода равно нулю. ЭДС = 0– (–0,195) = 0,195В.
КОНТРОЛЬНЫЕ ВОПРОСЫ
181. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=0,01 моль/л и цинкового в растворе хлорида цинка, [Mg2+]=0,01 моль/л. 182. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=0,01 моль/л и цинкового в растворе хлорида цинка, [Zn2+]=0,01 моль/л. 183. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=0,01 моль/л и никелевого в растворе хлорида никеля, [Ni2+]=0,01 моль/л. 184. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного цинковым и магниевым электродами, погруженными в растворы солей при концентрации (моль/л) [Zn2+]=0,1, [Mg2+]=1. 185. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=1 моль/л и цинкового в растворе хлорида цинка, [Zn2+]=0,01 моль/л. 186. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из двух свинцовых электродов, один из которых погружен в раствор соли свинца с концентрацией 0,1 моль/л, а другой – 0,0001 моль/л. 187. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного никелевым и палладиевым электродами, погруженными в растворы их солей, если [Ni2+]=0,01 моль/л, а [Pd2+]=0,1 моль/л.
188. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного оловянным и стандартным водородным электродами, если концентрация соли олова равна 0,0001 моль/л. 189. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы своих солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Вычислите ЭДС этого элемента, если [Zn2+]=0,0001 моль/л, а [Fe2+]=0,01 моль/л. 190. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного железным и стандартным водородным электродами, если концентрация соли [Fe3+] =0,001 моль/л. 191. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Mg2+]=0,01 моль/л, а [Pb2+]=0,1 моль/л. 192. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым и стандартным водородным электродами, если концентрация соли кадмия равна 0,01 моль/л. 193. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Ni2+]=0,01 моль/л, а [Pb2+]=0,0001 моль/л. 194. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного алюминиевым и стандартным водородным электродами, если концентрация соли алюминия равна 0,001 моль/л. 195. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению Cu + 2Ag+ = Cu2+ + 2Ag. Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Cu2+]=0,01 моль/л, а [Ag+]=0,001 моль/л. 196. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного серебряным и стандартным водородным электродами, если концентрация соли серебра равна 0,0001 моль/л. 197. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению Be + Pb2+ = Be2+ + Pb. Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Pb2+]=0,01 моль/л, а [Be2+]=0,1 моль/л. 198. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного никелевым и стандартным водородным электродами, если концентрация соли никеля равна 0,0001 моль/л. 199. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению Al + Cr3+ = Al3+ + Cr. Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Al3+]=0,001 моль/л, а [Cr3+]=0,0001 моль/л. 200. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевыми электродами, если концентрация соли кадмия при положительном электроде равна 1 моль/л, а при отрицательном – 0,0001 моль/л.
201. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению Cr + FeCl3= CrCl3 + Fe. Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Fe3+]=0,01 моль/л, а [Cr3+]=0,001 моль/л. 202. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного цинковым и стандартным водородным электродами, если концентрация соли цинка равна 0,0001 моль/л. 203. Составьте схему галванического элемента, в основе которого лежит реакция, протекающая по уравнению Co + Pb(NO3)2 = Co(NO3)2 + Pb. Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Co2+]=0,01 моль/л, а [Pb2+]=0,0001 моль/л. 204. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного хромовым и стандартным водородным электродами, если концентрация соли хрома равна 0,001 моль/л. 205. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде. 206. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, один из которых погружен в раствор соли серебра с концентрацией 0,1 моль/л, а другой – 0,01 моль/л. 207. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде. 208. Составьте схемы двух гальванических элементов, в одном из которых цинк был бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде. 209. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде. 210. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Электролиз
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 39421; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.103.14 (0.011 с.) |


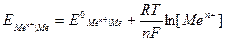 ,
, – равновесный электродный потенциал, В;
– равновесный электродный потенциал, В; – стандартный электродный потенциал, В;
– стандартный электродный потенциал, В;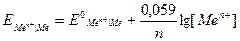 .
.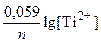 = –1,630 +
= –1,630 +  = –1,689 В;
= –1,689 В; = –0,136 +
= –0,136 + 


