Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рассмотрим, как влияет изменение температуры на равновесие.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В соответствии с принципом Ле Шателье, нагревание вызывает смещение равновесия в сторону того из двух встречных процессов, протекание которого сопровождается поглощением теплоты. Значит повышение температуры вызывает возрастание константы равновесия эндотермического процесса. Естественно, что понижение температуры приводит к смещению равновесия в сторону того процесса, протекание которого сопровождается выделением теплоты. Охлаждение благоприятствует экзотермическому процессу и вызывает увеличение константы его равновесия. Изменение давления также влияет на равновесие. При постоянной температуре константа равновесия не изменяется под действием давления. Однако относительные количества исходных веществ и продуктов под действием давления изменяются в том направлении, которое предсказывается принципом Ле Шателье. Если повысить давление при постоянной температуре, обьем смеси газов уменьшается, а концентрация реагентов увеличивается. В этом случае повышение давления будет компенсироваться тем, что реакция пойдет в направлении, соответствующем уменьшению суммарного числа молей присутствующих газов (в направлении уменьшения концентрации). При уменьшении давления смещение равновесия произойдет в сторону реакции с большим числом молей. На равновесие влияет и изменение концентрации. В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо реагента вызывает сдвиг равновесия в том направлении, при котором его концентрация уменьшается. Поэтому избыток исходного вещества (исходных веществ) вызывает смещение равновесия вправо. Добавление продукта (продуктов) реакции вызывает смещение равновесия влево.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Задача 1. Дана система N2(г) + 3H2(г) Рассчитать изменение скорости прямой химической реакции, если обьем системы уменьшить в 2 раза. Определить, в каком направлении сместится равновесие, если: а) в системе повысить давление; б) понизить температуру; в) увеличить концентрацию водорода. Решение: В соответствии с законом действия масс запишем выражения скорости прямой реакции:
Система гомогенная, все вещества находятся в газообразном состоянии. При уменьшении обьема системы в 2 раза концентрация реагентов возрастает также в 2 раза. Запишем новые выражения скоростей реакции:
Следовательно скорость прямой реакции возрастет в
Константа равновесия данной реакции запишется следующим образом:
Если в системе повысить давление, то объем уменьшится, а концентрация реагентов возрастет. Следовательно смещение равновесия произойдет в сторону реакции, уменьшающей концентрацию. Так как в данной реакции в левой части уравнения 4 моль вещества, а в правой – 2 моль, то смещение равновесия произойдет вправо. Реакция экзотермическая, то есть идет с выделением тепла. Если понизим температуру, то смещение равновесия произойдет вправо, в сторону экзотермической реакции. При увеличении концентрации водорода смещение равновесия произойдет в сторону реакции, уменьшающей концентрацию водорода, в данном случае вправо. Задача 2. В реакции С(т)+2H2(г) Решение. Согласно закону действия масс, начальная скорость реакции равна vн=k×[H2]2. После уменьшения концентрации водорода в 3 раза скорость станет равна vк=k×(1/3)2[H2]2 =1/9k[H2]2.. После изменения концентрации водорода скорость изменится следующим образом: vк/vн=1/9k[H2]2/k[H2]2=1/9. Ответ: скорость реакции уменьшится в 9 раз. Задача 3. В какую сторону сместится равновесие реакции 2SO2(г)+O2(г) Решение. Поскольку DH°<0, теплота выделяется в ходе прямой реакции, которая является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда способствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону исходных веществ. Ответ: влево. Задача 4. Как изменится скорость реакции при повышении температуры от 200С до 600С, если температурный коэффициент скорости реакции равен 2? Решение: Для решения применим правило Вант-Гоффа:
Следовательно, скорость реакции при повышении температуры возрастет в 16 раз. Задача 5. При температуре 500С некоторая реакция заканчивается за 2 мин. 15 с. Принимая температурный коэффициент скорости реакции равным 2, рассчитать, через какое время закончится эта реакция, если проводить ее при 700С? Решение: По правилу Вант-Гоффа рассчитаем, во сколько раз изменится скорость реакции.
Скорость реакции обратно пропорциональна времени реакции. Следовательно, можно записать:
Отсюда находим: Реакция закончится за 15 секунд.
КОНТРОЛЬНЫЕ ВОПРОСЫ В задачах под №№ 31-45 приведены уравнения реакций, находящихся в состоянии равновесия. Решите задачу в соответствии с условием. Задача 31 2H2(г) + O2(г) 1. Как изменится скорость прямой реакции, если давление в системе увеличить в 2 раза? 2. Во сколько раз изменится скорость реакции,если температуру повысить на 500С? γ = 2. 3. Написать выражение константы равновесия. Как надо изменить давление и температуру, чтобы сместить равновесие вправо? Задача 32 А(т) + 2В(г) 1. Как изменится скорость прямой реакции, если давление в системе уменьшить в 3 раза? 2. Во сколько раз изменится скорость реакции, если температуру повысить на 200С? γ = 2. 3. Написать выражение константы равновесия. Как надо изменить давление и температуру, чтобы сместить равновесие влево? Задача 33 CO2(г) + H2(г) 1. Как изменится скорость прямой реакции, если концентрацию водорода увеличить в 3 раза? 2. Во сколько раз изменится скорость реакции, если температуру понизить на 300С? γ = 4. 3. Написать выражение константы равновесия. Куда сместится равновесие, если: а) температуру повысить; б) давление понизить? Задача 34 А2(г) + 3В(г) 1. Как изменится скорость обратной реакции, если объем системы уменьшить в 2 раза? 2. Во сколько раз изменится скорость реакции, если температуру понизить на 200С? γ = 3. 3. Написать выражение константы равновесия. Как надо изменить объем и температуру, чтобы сместить равновесие влево?
Задача 35 2SO2(г) + O2(г) 1. Как изменится скорость прямой реакции, если концентрацию SO2 увеличить в 2 раза, а концентрацию О2 уменьшить в 2 раза? 2. Во сколько раз изменится скорость реакции, если температуру повысить на 300С? γ = 2. 3. Написать выражение константы равновесия. Куда сместится равновесие, если: а) температуру понизить; б) давление повысить? Задача 36 N2(г) + 3H2(г) 1. Как изменится скорость прямой реакции, если давление в системе уменьшить в 3 раза? 2. Чему равен температурный коэффициент, если температуру понизили на 400С, а скорость реакции изменилась в 81 раз? 3. Написать выражение константы равновесия. Куда сместится равновесие, если а) концентрацию N2 увеличить; б) температуру уменьшить? Задача 37 FeO(т) + СO(г) 1. Как изменится скорость прямой реакции, если концентрацию CO увеличить в 5 раз? 2. Во сколько раз изменится скорость реакции, если температуру повысить на 100С? γ = 3. 3. Написать выражение константы равновесия. Как надо изменить объем и температуру, чтобы равновесие сместить влево? Задача 38 MgCO3(т) 1. Как изменится скорость обратной реакции, если объем СО2 увеличить в 3 раза? 2. Чему равен температурный коэффициент реакции, если скорость реакции изменилась в 8 раз при понижении температуры на 300С? 3. Написать выражение константы равновесия. Куда сместится равновесие при понижении температуры и уменьшении концентрации СО2? Задача 39 2N2O(г) 1. Как изменится скорость обратной реакции, если объем уменьшить в 3 раза? 2. Во сколько раз изменится скорость реакции, если температуру повысить на 400С? γ = 3 3. Написать выражение константы равновесия. Куда сместится равновесие при уменьшении температуры и давления? Задача 40 4HCl(г) + O2(г) 1. Как изменится скорость прямой реакции, если концентрацию HCl понизить в 2 раза, а концентрацию О2 увеличить в 8 раз? 2. Во сколько раз изменится скорость реакции, если температуру понизить на 500С? γ = 2 3. Написать выражение константы равновесия. Как надо изменить давление и температуру, чтобы равновесие сместить влево? Задача 41 N2O4(г) 1. Как изменится скорость обратной реакции, если давление повысить в 4 раза? 2. Чему равен температурный коэффициент реакции, если при понижении температуры на 100С скорость реакции изменится в 2 раза? 3. Написать выражение константы равновесия. Как надо изменить давление и температуру, чтобы сместить равновесие влево? Задача 42 2АВ(г) 1. Как изменится скорость обратной реакции, если концентрацию А2 уменьшить в 5 раз? 2. На сколько градусов нужно повысить температуру, если скорость реакции изменилась в 8 раз?γ =2 3. Написать выражение константы равновесия. Как надо изменить давление и температуру, чтобы сместить равновесие вправо? Задача 43 С(т) + СO2(г)
1. Как изменится скорость прямой реакции, если объем уменьшить в 10 раз? 2. На сколько градусов нужно понизить температуру, чтобы скорость реакции изменилась в 16 раз? γ = 2. 3. Написать выражение константы равновесия. Куда сместится равновесие, если повысить давление и температуру? Задача 44 2СО(г) + O2(г) 1. Как изменится скорость прямой реакции, если давление увеличить в 5 раз? 2. На сколько градусов нужно повысить температуру, чтобы скорость реакции увеличилась в 64 раза? γ = 2. 3. Написать выражение константы равновесия. Как нужно изменить объем и температуру, чтобы равновесие сместилось влево? Задача 45 N2(г) + О2(г) 1. Как изменится скорость обратной реакции, если объем уменьшить в 3 раза? 2. На сколько градусов нужно понизить температуру, чтобы скорость реакции уменьшилась в 27 раз? γ = 3 3. Написать выражение константы равновесия. Как нужно изменить давление и температуру, чтобы равновесие сместилось вправо? Задача 46 СаCO3(к)
1. Как изменится скорость обратной реакции, если концентрацию СО2 увеличить в 7 раз? 2. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 27 раз? γ =3 3. Написать выражение константы равновесия. Куда сместится равновесие, если: а) температуру понизить: б) давление повысить? Задача 47 2NО(г) + О2(г) 1. Как изменится скорость прямой реакции, если объем уменьшить в 3 раза? 2. На сколько градусов нужно понизить температуру, чтобы скорость реакции уменьшилась в 64 раза? γ = 3 3. Написать выражение константы равновесия. Как нужно изменить температуру и концентрацию NO, чтобы равновесие сместилось вправо? Задача 48 СОCl2(г) 1. Как изменится скорость обратной реакции, если концентрацию СО увеличить в 4 раза, а концентрацию Cl2 уменьшить в 2 раза? 2. На сколько градусов нужно повысить температуру, чтобы скорость реакции увеличилась в 9 раз? γ = 3. 3. Написать выражение константы равновесия. Куда сместится равновесие, если увеличить давление и понизить температуру? Задача 49 2СО(г) 1. Как изменится скорость прямой реакции, если объем уменьшить в 7 раз? 2. На сколько градусов нужно понизить температуру, чтобы скорость реакции уменьшилась в 81 раз? γ = 3. 3. Написать выражение константы равновесия. Как надо изменить концентрацию СО и температуру, чтобы сместить равновесие вправо? Задача 50 4HCl(г) + О2(г) 1. Как изменится скорость обратной реакции, если давление увеличить в 3 раза? 2. Чему равен температурный коэффициент реакции, если при повышении температуры на 100С,скорость реакции изменится в 4 раза? γ = 3. 3. Написать выражение константы равновесия. Куда сместится равновесие, если: а) температуру повысить: б) объем увеличить? Задача 51 А2(г) + В2(г) 1. Как изменится скорость обратной реакции, если объем уменьшить в 5 раз? 2. Во сколько раз изменится скорость реакции, если температуру повысить на 600С? γ =2 3. Написать выражение константы равновесия. Как надо изменить концентрацию А2 и температуру, чтобы сместить равновесие вправо? Задача 52 2SО3(г) 1. Как изменится скорость прямой реакции, если давление повысить в 4 раза? 2. Чему равен температурный коэффициент, если скорость реакции изменилась в 16 раз при понижении температуры на 200С? 3. Написать выражение константы равновесия. Как надо изменить давление и температуру, чтобы сместить равновесие вправо? Задача 53 3N2О(г) + 2NН3(г) 1. Как изменится скорость прямой реакции, если объем увеличить в 2 раза? 2. На сколько градусов нужно повысить температуру, чтобы скорость реакции увеличилась в 32 раза? γ = 2. 3. Написать выражение константы равновесия. Куда сместится равновесие, если: а) температуру повысить: б) давление понизить? Задача 54 СО(г) + 2Н2(г) 1. Как изменится скорость прямой реакции, если давление уменьшить в 3 раза? 2. Во сколько раз изменится скорость реакции, если температуру повысить на 600С? γ = 2. 3. Написать выражение константы равновесия. Куда сместится равновесие, если температуру и давление повысить? Задача 55 3О2(г) 1. Как изменится скорость обратной реакции, если давление увеличить в 7 раз? 2. Во сколько раз изменится скорость реакции, если температуру увеличить на 300С? γ = 3. 3. Написать выражение константы равновесия. Куда сместится равновесие, если: а) температуру повысить: б) давление понизить? Задача 56 2СО2(г) 1. Как изменится скорость прямой реакции, если объем увеличить в 6 раз? 2. Во сколько раз изменится скорость реакции, если температуру увеличить на 500С? γ = 2. 3. Написать выражение константы равновесия. Как надо изменить концентрацию СО2 и температуру, чтобы равновесие сместилось вправо? Задача 57 СО2(г) + Н2(г) 1. Как изменится скорость прямой реакции, если объем увеличить в 3 раза? 2. Во сколько раз изменится скорость реакции, если температуру понизить на 400С? γ = 2. 3. Написать выражение константы равновесия. Как надо изменить объем и температуру, чтобы равновесие сместилось влево? Задача 58 2SО3(г) 1. Как изменится скорость прямой реакции, если давление повысить в 5 раз? 2. Чему равен температурный коэффициент, если скорость реакции изменилась в 256 раз при повышении температуры на 400С? 3. Написать выражение константы равновесия. Куда сместится равновесие при повышении температуры и концентрацииSО3? Задача 59 СО(г) + Н2О(г) 1. Как изменится скрость прямой реакции, если объем увеличить в 3 раза? 2. Во сколько раз изменится скорость реакции, если температуру понизить на 400С? γ= 3. 3. Написать выражение константы равновесия. Как надо изменить объем и температуру, чтобы сместить равновесие влево? Задача 60 2SO3(г) 1. Как изменится скорость прямой реакции, если давление повысить в 5 раз? 2. Чему равен температурный коэффициент, если при понижении температуры на 300С скорость реакции изменится в 81 раз? 3. Написать выражение константы равновесия. Куда сместится равновесие при повышении температуры и концентрации SO3?
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2126; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.211.246 (0.007 с.) |

 2NH3(г); ΔН<0.
2NH3(г); ΔН<0.


 ;
;

 ;
;

 .
. .
. CH4(г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции?
CH4(г) концентрацию водорода уменьшили в 3 раза. Как изменится скорость реакции? ;
; 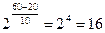 .
.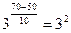 ; з начит отношение:
; з начит отношение: 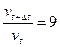 .
. .
. .
.