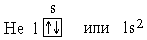Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронная структура атомовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для определения состояния электрона в многоэлектронном атоме важное значение имеет принцип Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь, характеризующаяся определенными значениями n, l и ml, может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными. Пользуясь принципом Паули, можно подсчитать, какое максимальное число электронов может находиться на каждом подуровне, т.е. определить емкость подуровней:
Здесь электроны на орбиталях изображены стрелками, направленными вверх или вниз в зависимости от знака спинового квантового числа. При l =0, т.е. на s-подуровне, имеется всего одна орбиталь, которую принято изображать в виде клетки. В атоме Н единственный электрон находится на самом низком из возможных энергетических состояний, т.е. на s-подуровне первого электронного слоя (на 1s-подуровне). Электронную структуру атома Н можно представить схемой:
В атоме гелия порядковый номер которого в периодической системе (или заряд ядра Z) равен 2, второй электрон тоже находится в состоянии 1s. Электронная структура атома гелия:
У этого атома завершается заполнение ближайшего к ядру K-слоя и тем самым завершается построение первого периода системы элементов. Рассмотренные для атомов H и He способы описания электронных оболочек называются электронно-графическими формулами (орбитали изображаются в виде клеток) и элетронными формулами (подуровни обозначаются буквами, а количество электронов на них указано верхним индексом). У следующего за гелием элемента литя (Z =3) третий электрон уже не может разместиться на орбитали K-слояK-слоем называется первый электронный слой атома.: это противоречило бы принципу Паули. Поэтому он занимает s-состояние второго энергетического уровня (L-слойL-слоем называется второй электронный слой атома., n =2). Его электронная структура записывается формулой 1s22s1, что соответствует схеме:
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:
Анализ атомного спектра показывает, что правильна последняя схема. Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Пользуясь правилом Хунда, нетрудно составить схему электронного строения для атома азота (Z =7):
O 1s22s22p4 F 1s22s22p5 Ne 1s22s22p6 Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Такие элементы называются s-элементамиГоворя по-другому, они относятся к семейству s-элементов. (т.е. они относятся к s-семейству элементов). Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Это атомы p-элементов (принадлежат к p-семейству). Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Однако электронное строение атомов определяет свойства элементов и их соединений. В этом состоит сущность периодического закона: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра. У атома аргона остаются незанятыми все орбитали 3d-подуровня. Однако у следующих за аргоном элементов – калия и кальция – заполнение 3-го электронного слоя временно прекращается, и начинает формироваться s-подуровень 4-го слоя. Такой порядок заполнения вытекает из первого правила Клечковского. Первое и второе часто не разделяют, а считают одним совместным правилом. Правила Клечковского: при увеличении заряда ядра атомов заполнение энергетических уровней происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n+l) к орбиталям с большим значением этой суммы. Следовательно, 4s-подуровень (n + l =4) должен заполняться раньше, чем 3d (n+l =5). Для атома скандия возникает вопрос: какой из подуровней должен заполняться – 3d или 4p, т.к. сумма n+l для них одинакова и равна 5. В подобных случаях порядок заполнения определяется вторымПервое и второе правила Клечковского часто не разделяют, а считают одним совместным правилом Клечковского, согласно которому при одинаковых значениях суммы (n+l) орбитали заполняются в порядке возрастания главного квантового числа n. Заполнение 3d-подуровня происходит у десяти элементов от Sc до Zn. Это атомы d-элементов. Затем начинается формирование 4p-подуровня (p-элементы от Ga до Kr). Как и атомы предшествующих благородных газов – неона и аргона – атом криптона характеризуется структурой внешнего электронного слоя ns2np6. Аналогично формируется пятый период. В шестом периоде после заполнения 6s-подуровня начинается заполнение 4f-подуровня, и следуют атомы f-элементов. В связи с тем, что у них внешним является шестой уровень, а электроны последовательно занимают 4-й уровень, лежащий гораздо ближе к ядру, то химические свойства всех этих f-элементов близки к лантану, поэтому их часто называют лантаноидами (в 7-м периоде f-элементы называются актиноидами). После 4f заполняется 5d и, наконец, 6p-подуровень, заполнением которого заканчивается построение шестого периода. Седьмой период не завершен, т.к. элементы с большим зарядом ядра оказываются очень неустойчивыми (легко протекают ядерные реакции). Порядок заполнения подуровней в соответствии с правилами Клечковского можно записать в виде последовательности: 1s ® 2s ® 2p ® 3s ® 3p ® 4s ® 3d ® 4p ® 5s ® 4d ® 5p ® 6s ® 4f ® 5d ® 6p ® 7s ® 5f ® 6d ® 7p. Однако для некоторых элементов эта последовательность нарушается, т.е. из правил.Клечковского имеются исключения. У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома. Например, электронная формула атома меди имеет вид: Cu 1s2 2s2 2p6 3s2 3p6 3d10 4s1, т.е. один из двух 4s-электронов “проваливается” на 3d-подуровень. Особо следует отметить палладий, у которого “проваливаются” два электрона: Pd 1s2 2s2 2p6 3s2 3p6 4s2 4p6 4d10 5s0. Второй тип исключений из правила Клечковского состоит в том, что перед заполнением 4f-подуровня один электрон располагается на 5d-подуровне: La 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f0 5s2 5p6 5d1 6s2. У следующего элемента (церия) 5d-подуровень освобождается, и оба электрона располагаются на 4f-подуровне: Ce 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f2 5s2 5p6 5d0 6s2. Аналогично, в 7-м периоде у актиния последний из электронов располагается на 6d-подуровне (а не на 5f, как должно быть по правилам Примеры решения задач. Задача 1. Напишите электронную формулу атома меди. Сколько электронов находится на d-подуровне предпоследнего электронного слоя? К какому электронному семейству относится элемент? Решение: атом Cu имеет порядковый номер 29. Следовательно, в его оболочке содержится 29 электронов. В электронной формуле распределяем их по подуровням согласно порядку заполнения (в соответствии с правилами Клечковского) и учитывая емкость подуровней: Cu: 1s22s22p63s23p63d94s2 При этом порядок заполнения подуровней следующий: 1s ® 2s ® 2p ® 3s ® 3p ® 4s ® 3d. Последний электрон располагается на 3d-подуровне, значит, медь относится к семейству d-элементов. Но электронная формула атома меди имеет вид: Cu 1s2 2s2 2p6 3s2 3p6 3d10 4s1, т.е. один из двух 4s-электронов “проваливается” на 3d-подуровень. На d-подуровне предпоследнего (3-го) слоя находится 10 электронов. Ответ: 10, d. Задача 2. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p63d104s24p64d105s25p1? Решение: количество электронов в оболочке нейтрального атома составляет 49. Поэтому его заряд ядра и, следовательно, порядковый номер, также равны 49. В периодической системе Д.И.Менделеева находим, что этот элемент – индий. Ответ: In. Задача 3. Напишите электронную формулу элемента, находящегося под № 43. К какому электронному семейству относится элемент? Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. Решение: атом Ru (рутений) имеет порядковый номер 44. Следовательно, в его оболочке содержится 44 электрона. В электронной формуле распределяем их по подуровням согласно порядку заполнения (в соответствии с правилами Клечковского) и учитывая емкость подуровней: Ru: 1s22s22p63s23p63d104s2 4p6 4d65s2 При этом порядок заполнения подуровней следующий: 1s ® 2s ® 2p ® 3s ® 3p ® 4s ® 3d ® 4p ® 5s ® 4d.Последний электрон располагается на 4d-подуровне, значит, рутений относится к семейству d-элементов. Следовательно валентными электронами будут 4d65s2. В невозбужденном состоянии (которое называется также основным состоянием) атом рутения имеет четыре неспаренных электрона, однако для него характерны соединения, в которых он образует шесть ковалентных связей. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов последнего пятого уровня переходит на p-подуровень:
КОНТРОЛЬНЫЕ ВОПРОСЫ 61. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? 62. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? 63. Напишите электронные формулы атомов элементов с порядковыми номерами 25 и 34. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? 64. Напишите электронную формулу атома цинка. Сколько электронов находится на последнем s-подуровне? К какому электронному семейству относится элемент? а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 70. Напишите электронную формулу элемента, находящегося под № 42. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 71. Напишите электронную формулу элемента, находящегося под № 24. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 72. Напишите электронную формулу элемента, находящегося под № 33. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 73. Напишите электронную формулу элемента, находящегося под № 82. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 74. Напишите электронную формулу элемента, находящегося под № 35. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 75. Напишите электронную формулу элемента, находящегося под № 53. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно.
76. Напишите электронную формулу элемента, находящегося под № 38. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 77. Напишите электронную формулу элемента, находящегося под № 26. Распределите валентные электроны по атомным орбиталям а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно.
78. Напишите электронную формулу элемента, находящегося под № 27. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 79. Напишите электронную формулу элемента, находящегося под № 43. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 80. Напишите электронную формулу элемента, находящегося под № 74. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 81. Напишите электронную формулу элемента, находящегося под № 39. Распределите валентные электроны по атомным орбиталям: а) в нормальном состоянии атома, б) в возбуждённом состоянии атома, если возбуждение возможно. 82. Атом какого элемента имеет электронную конфигурацию: 1s22s22p63s23p63d104s1? 84. Напишите электронную формулу элемента, у которого на 3d-подуровне находятся 3 электрона. Что это за элемент? 89. Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Покажите распределение электронов этих атомов по квантовым ячейкам. Сколько свободных d – орбиталей в атомах этих элементов? 90. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Покажите распределение электронов этих атомов по квантовым ячейкам. Сколько свободных d – орбиталей у атомов последнего элемента?
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1170; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.0.93 (0.007 с.) |