Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ряд напряжений. Гальванические элементы (ГЭ)Содержание книги
Поиск на нашем сайте
Гальванические элементы (ГЭ) – это химические источники тока (ХИТ) одноразового действия. Они состоят из электродов (проводники первого рода), погруженных в растворы или расплавы электролитов (проводники второго рода). В ГЭ энергия химической окислительно-восстановительной реакции непосредственно преобразуется в электрическую. Простейшая электрохимическая схема ГЭ: (-) электрод, / электролит 1 // электролит 2 / электрод, (+) имеющий меньшее С1 (моль/л) С2 (моль/л) имеющий большее значение электродного значение электродного потенциала потенциала
Электрохимический процесс занимает важное место на пути превращения химической энергии топлива в электрическую. Электрохимические превращения находят своё воплощение и в других химических источниках тока (топливные элементы, аккумуляторы). Мощность всех работающих в настоящее время ХИТ соизмерима с мощностью всех электростанций в мире. Они обеспечивают автономное питание радиотехнической и электронной аппаратуры, работают бесшумно, не загрязняют окружающую среду, просты в обслуживании, имеют высокий КПД. Цель работы 1. Исследовать восстановительную способность металлов в ряду напряжений. 2. Собрать цинково-медный гальванический элемент, измерить его напряжение при различных концентрациях солей цинка и меди. 3. Рассчитать теоретическое значение напряжения гальванического элемента. 4. Определить абсолютную и относительную ошибки опыта. Опыт №1. Вытеснение водорода из кислоты металлами Выполнение опыта В три пробирки налить по 2–3 мл 2н. раствора соляной кислоты HCl и поместить (порознь) по кусочку магния, цинка и меди, предварительно зачищенных наждачной бумагой с целью удаления оксидных пленок. Наблюдения и выводы 1. Составить молекулярные и ионно-молекулярные уравнения реакций. 2. Какие из взятых металлов вытесняют водород из разбавленной соляной кислоты? 3. Составить электронные уравнения к ОВР. 4. Объяснить различную скорость вытеснения водорода из кислоты металлами. 5. Разместить металлы в ряд в порядке уменьшения их активности. Сравнить с рядом напряжений металлов. Опыт №2. Вытеснение металлов из растворов их солей другими металлами Выполнение опыта Налить в две пробирки по 2 – 3 мл 0,5н. раствора сульфата меди CuSO4 и опустить в одну из них, очищенную от ржавчины, железную проволоку, в другую – очищенную алюминиевую проволоку. Проделать аналогичный опыт с 0,1н. раствором нитрата свинца Pb(NO3)2, опустив в одну из пробирок гранулированный цинк, в другую – медную проволоку.
Наблюдения и выводы 1. Результаты наблюдений записать в таблицу 14.1. Отметить знаком «+» вытеснение металла из раствора его соли и знаком «–» отсутствие вытеснения. Таблица 14.1 Результаты наблюдений
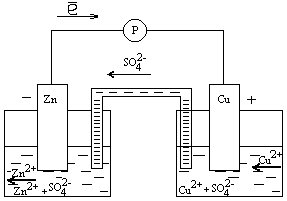
2. Написать молекулярные и ионно-молекулярные уравнения происходящих реакций, сопроводить их электронными уравнениями. Опыт №3. Цинково-медный гальванический элемент Выполнение опыта Собрать прибор, изображенный на схеме 14.2. Один из стаканов наполнить раствором сульфата меди С(CuSO4) = 1моль/л и опустить в него медную пластинку, а второй – раствором сульфата цинка С(ZnSO4)=1моль/л и опустить в него цинковую пластинку. Пластинки хорошо зачистить наждачной бумагой. Соединить растворы в стаканах электролитным мостиком, заполненным раствором хлорида калия KCl. Использовать различные концентрации растворов: ZnSO4 (1М), CuSO4 (1М); ZnSO4 (0,1М), CuSO4 (1M); ZnSO4 (1М), CuSO4 (0,1M) и другие (по указанию преподавателя). С помощью рН-метра, иономера или вольтметра замерить электродные потенциалы анода и катода, а затем и напряжение ГЭ (метод измерения описан в лабораторной работе №13 «Определение электродных потенциалов металлов»).
Схема 14.2. Цинково-медный гальванический элемент
Наблюдения и выводы 1.Все результаты записать в таблицу 14.2. Таблица 14.2
2. Пересчитать измеренные потенциалы электродов на водородную шкалу по формуле: φ по в.ш. = φпо х.с. + 0,2,В. (14.1) 3. Значение расчетного электродного потенциала проводить по уравнению Нернста. 4. Рассчитать теоретическое значение напряжения ГЭ по формуле: ε = φк - φа . (14.2) 5. Записать электрохимическую схему гальванического элемента; электродные процессы и суммарную реакцию, происходящие при его работе.
ЛАБОРАТОРНАЯ РАБОТА № 15 Коррозия металлов
Коррозией металлов называется процесс химического разрушения металлов под действием окружающей среды. Причиной коррозии является термодинамическая неустойчивость металлов в различных средах. Все коррозионные процессы протекают самопроизвольно с уменьшением свободной энергии (∆G). По механизму протекания различают химическую и электрохимическую коррозию. Под химической коррозией понимают окисление металла, не сопровождающееся возникновением в системе электрического тока. Процессы окисления и восстановления не разделены друг от друга в пространстве. Электрохимическая коррозия - разрушение металла в среде электролита в результате реакций электрохимического характера. Эта коррозия обусловлена двумя протекающими раздельно процессами – анодным и катодным. Электрохимическая коррозия протекает по двум различным механизмам и подразделяется на два типа: гальванокоррозию и электрокоррозию. В практике часто имеют дело с контактом двух различных металлов. При наличии электролита в месте контакта самопроизвольно возникает коррозионный гальванический элемент. При гальванокоррозии различают атмосферную коррозию (в нейтральной среде) и коррозию в кислой среде (как в присутствии кислорода, так и в отсутствии кислорода). Рассмотрим, например, коррозию железа, контактирующего с медью, в различных условиях. 1).Атмосферная коррозия в нейтральной среде в присутствии кислорода. Схема возникающего при этом коррозионного элемента: (-) Fe / H2O, O2 / Cu (+) Знаки электродов во внешней цепи указывают на меньшее (-) и большее (+) значение величин стандартных электродных потенциалов металлов: φFe2+/Fe = -0,44B; φCu2+/Cu = 0,34B. На аноде протекает процесс: Fe - 2e- = Fe2+, а на катоде: 2Н2О + О2 +4е- = 4ОН- (кислородная деполяризация). Суммарная реакция: 2Fe + 2Н2О + О2 = 2Fe(ОН)2. Продуктом коррозии является гидроксид железа (II), который окисляется до гидроксида железа (III): 4Fe(ОН)2 + 2Н2О + О2 = 4Fe(ОН)3, который, теряя молекулу воды, превращается во ржавчину: Fe(ОН)3 → Н2О + FeООН (оксид гидроксид железа (III).
2) Коррозия в нейтральной среде в отсутствии кислорода. Схема коррозионного гальванического элемента: (-) Fe / Н2О / Cu (+). Анодный процесс: Fe - 2e- = Fe2+; катодный: 2Н2О + 2е- = Н2 + 2ОН- (водородная деполяризация). Суммарная реакция: Fe + 2H2O = H2 + 2Fe(OH)2. Продуктом коррозии, как и в первом случае, является гидроксид железа (II), который далее превращается в гидроксид железа (III) и во ржавчину.
3). Коррозия железа в растворе серной кислоты в присутствии кислорода. Схема коррозионного гальванического элемента: (-) Fe / Н2SО4, O2 / Cu (+). Анодный процесс: Fe - 2e- = Fe2+; катодный: О2 + 4Н+ + 4е- = 2Н2О. Суммарная реакция: 2Fe + О2 + 4Н+ = 2 Fe2+ + 2Н2О. Продуктом коррозии является соль – сульфат железа (II) FeSО4.
4). Коррозия железа в растворе хлороводородной кислоты в отсутствии кислорода. Схема коррозионного гальванического элемента: (-) Fe / НСl / Cu (+). На аноде протекает процесс: Fe - 2e- = Fe2+; на катоде: 2Н+ + 2е- = Н2. Суммарная реакция: Fe + 2Н+ = Fe2+ + Н2. Продуктом коррозии является соль – хлорид железа (II) FeСl2. Для оценки скорости коррозии используют показатели коррозии. Весовой показатель коррозии: ∆m Km = ---------; г/м2 ч,(15.1) τ S
где ∆m - масса металла, разрушенного за время коррозии, г;
τ – время коррозии, ч, S – площадь поверхности корродируемого металла, м2.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 1480; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.67.67 (0.009 с.) |