
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение температуры замерзания антифризаСодержание книги
Поиск на нашем сайте Большинство промышленных и сельскохозяйственных процессов, а также обменные процессы в живых организмах протекают в водных растворах, что предопределяет необходимость знания характеристик и законов, описывающих их поведение. Антифризы (жидкости, замерзающие при отрицательных температурах) применяются в системах охлаждения автомобильных, авиационных и тракторных двигателей при температуре окружающего воздуха от –75 до 0оС. Они должны удовлетворять следующим требованиям: иметь высокую емкость и теплопроводность, низкую температуру замерзания, не вызывать коррозию, быть негорючими и неядовитыми, дешевыми и распространенными. Антифризы получают путем растворения в воде некоторых органических веществ (например, этиленгликоля, глицерина и др.) и антикоррозийных добавок: декстрина (1г/л), гидроортофосфата (Na2HPO4; 2,5-3,5г/л). Гидроортофосфат защищает от коррозии чугунные, стальные, медные и латунные детали; декстрин – свинцово-оловянные припои, алюминий и медь. Маркировка антифризов связана с температурой их замерзания. Для зон с умеренным климатом рекомендуется антифриз А-65 и др. Наиболее распространенным антифризом в настоящее время является водный раствор этиленгликоля НОН2С - СН2ОН с соответствующими добавками. Этиленгликоль – бесцветная вязкая жидкость с температурой кипения 198оС (при 101,3кПа), температурой замерзания -12оС.
Действие антифризов основано на криоскопическом законе Рауля, согласно которому понижение температуры замерзания (кристаллизации) раствора ∆tзам. по сравнению с чистым растворителем прямо пропорционально моляльной концентрации раствора.
mB 1000 ∆t = tо - tзам. р. = Кr Cm(B) = Кr --------------, (5.1) MB mo
где tо - температура замерзания чистого растворителя (воды); tзам. р. - температура замерзания раствора; Cm(B) – моляльность растворенного вещества, моль/кг; mB – масса растворенного вещества, г; MB – молярная масса растворенного вещества, г/моль; mo - масса растворителя (воды), г; Кr - криоскопический коэффициент (для воды Кr = 1,858 К кг моль-1). Цель работы Определить температуру замерзания антифриза. Работу выполняют два студента. Выполнение опыта Для определения температуры замерзания применяют прибор, называемый криоскопом. Его схема приведена на рис.5.1.
Прибор состоит из реакционной пробирки 1, куда помещается исследуемый раствор. Пробирка закрывается пробкой, в которую вставляются термометр 2 (с ценой деления 0,01-0,1оС) и мешалка 3 – проволока с кольцом на нижнем конце. Реакционная пробирка с термометром и мешалкой помещается в стакан 4 с охлаждающей смесью.
Рис.5.1. Схема криоскопа
Для проведения эксперимента следует достать из прибора пробирку 1, вынуть пробку с термометром и мешалкой и налить в пробирку 10 см3 исследуемого раствора. Закрыть пробирку пробкой с термометром и мешалкой и тщательно перемешать раствор. Опустить пробирку с раствором в охладительную смесь и, непрерывно помешивая мешалкой раствор, наблюдать за изменением его температуры.
Наблюдения и выводы
1. Начиная примерно с +4оС, отмечать показания термометра через каждые 10 секунд. Полученные данные занести в таблицу 5.1, форма которой приведена ниже.
Таблица 5.1 Температурные данные
3. Построить график зависимости изменения температуры раствора от времени - кривую охлаждения (рис. 5.2 а, б).
Рис. 5.2. Кривая охлаждения
3. Определить по графику температуру замерзания раствора. 4. Используя закон Рауля, рассчитать теоретическую температуру замерзания раствора антифриза. Растворенное вещество, его массу и массу воды, содержащихся в данном растворе называет преподаватель. Температуру замерзания чистой воды (растворителя) принять равной 0°С. 5. Найти абсолютную и относительную погрешности эксперимента. Исследуемый раствор антифриза сдать лаборанту.
ЛАБОРАТОРНАЯ РАБОТА № 6 Химические реакции в растворах электролитов Существенным свойством электролитов является то, что реакции, протекающие в их растворах, есть реакции между ионами. Если исходные вещества и продукты реакции – сильные электролиты, то между ними устанавливается ионное равновесие, не приводящее к образованию какого-либо нового вещества. Например: Na2SO4 + 2KNO3 = K2SO4 + 2 NaNO3 (молекулярное уравнение) 2Na+ + SO42- + 2K+ + 2NO3- ↔ 2K+ + SO42- + 2Na+ + 2NO3- (полное ионное уравнение) Равновесие реакции сдвигается вправо, если в результате реакции образуются: 1) слабые электролиты а) NaOH + HCl = NaCl + H2O
Na+ + OH- + H+ + Cl- → Na+ + Cl- + H2O (полное ионно-молекулярное уравнение) OH- + H+ → H2O (краткое ионно-молекулярное уравнение)
б) CH3COONa + HCl = CH3COOH + NaCl CH3COO- + Na+ + H+ + Cl- → CH3COOH + Na+ + Cl- CH3COO- + H+ → CH3COOH в) NH4Cl + NaOH = NH4OH + NaCl NH4+ + Cl- + Na+ + OH- → NH4OH + Na+ + Cl- NH4+ + OH- → NH4OH
2) труднорастворимые вещества (осадки)
а) 2NaI + Pb(NO3)2 = PbI2 ↓ + 2NaNO3 2Na+ + 2I- + Pb2+ + 2NO3- → PbI2↓ + 2Na+ + 2NO3- 2I- + Pb2+ → PbI2↓ б) BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl Ba2+ + 2Cl- + 2Na+ + SO42- → BaSO4↓ + 2Na+ + 2Cl- Ba2+ + SO42- → BaSO4↓
3) газообразное вещество
Na2S + 2HCl = H2S↑ + 2NaCl 2Na+ +S2- + 2H+ + 2Cl- → H2S↑ + 2Na+ + 2Cl- S2- + 2H+ → H2S↑
4) комплексное соединение
KCN + AgCN = K[Ag(CN)2] K+ + CN- + Ag+ + CN- → K+ + [Ag(CN)2]- CN- + Ag+ + CN- → [Ag(CN)2]- (комплексный ион) Цель работы 1. Приобрести навык составления ионных уравнений в растворах электролитов. 2. Закрепить школьные знания по классификации и номенклатуре основных классов неорганических соединений. Опыт 1. Получение малорастворимых гидроксидов Выполнение опыта В одну пробирку налить 20 капель 0,5н. раствора хлорида железа (III) или сульфата железа (III). В другую пробирку – 20 капель 0,5н. сульфата меди (II). В третью пробирку – 20 капель 0,5н. раствора хлорида аммония. В каждую пробирку по каплям прибавить 2н. раствор гидроксида натрия или гидроксида калия до появления осадков. Наблюдения и выводы 1. Отметить цвет образовавшихся осадков. 2.Написать молекулярные и ионно-молекулярные уравнения соответст-вующих реакций. 3. Взаимодействие каких ионов происходит в каждом случае? Опыт 2. Получение малорастворимых кислот Выполнение опыта В пробирку налить 20 капель раствора силиката натрия (силикатный клей) с массовой долей 10%. Добавить несколько капель 1н. раствора соляной кислоты до образования осадка. Наблюдения и выводы 1. Какая малорастворимая кислота образовалась? 2. Написать молекулярное и ионно-молекулярные уравнения данного процесса. 3. Какие ионы участвовали в образовании данной кислоты? Опыт 3. Образование слабых кислот Выполнение опыта В две пробирки налить 20 капель 0,5н. раствора карбоната натрия. В третью пробирку внести 20 капель 0,5н. раствора сульфида натрия. В первую пробирку добавить несколько капель 1н. раствора соляной кислоты до появления пузырьков газа. Во вторую пробирку – столько же капель 1н. раствора уксусной кислоты. В третью пробирку – по каплям 1н. раствор соляной кислоты до появления газа с неприятным запахом. Наблюдения и выводы 1. Что образовалось в каждой из пробирок? 2. Написать молекулярные и ионно-молекулярные уравнения данных химических реакций. 3. Какие ионы образовали полученные вещества? Опыт 4. Получение малорастворимых солей Выполнение опыта. В две пробирки налить по 20 капель 0,1н. раствора нитрата свинца, в одну добавить несколько капель 2н. раствора серной кислоты, во вторую – несколько капель 0,5н. раствора иодида калия до образования осадков. В третью пробирку налить 20 капель 0,1н. раствора хлорида железа (II) или сульфата железа (II), добавить несколько капель 0,5н. раствора сульфида натрия до образования осадка. Наблюдения и выводы 1. Отметить цвет образовавшихся осадков. 2. Написать молекулярные и ионно-молекулярные уравнения этих реакций. 3. Какие ионы участвовали в их образовании? Опыт 5. Амфотерные гидроксиды и их свойства Выполнение опыта В четыре пробирки налить по 20 капель следующих 0,5н. растворов: сульфата цинка, сульфата аммония, сульфата меди и сульфата марганца. В каждую пробирку добавлять по каплям 2н. раствор гидроксида натрия или гидроксида калия до образования осадков. Каждый из полученных осадков взболтать и разделить на 2 части. На одну часть подействовать 1н. раствором соляной кислоты, на другую – 2н. раствором гидроксида натрия или калия (по каплям). Наблюдения и выводы 1. Написать молекулярные и ионно-молекулярные уравнения реакций образования гидроксидов. 2. Процессы растворения гидроксидов в кислоте и в щелочи выразить молекулярными и ионно-молекулярными уравнениями реакций. 3.Записать выводы в форме таблицы 6.1: Таблица 6.1
ЛАБОРАТОРНАЯ РАБОТА № 7 Гидролиз солей Гидролизом солей называют процесс ообменного взаимодействия соли с водой с образованием малодиссоциированного соединения. При этом меняется реакция среды (рН). Гидролизу подвергаются соли, образованные сильной кислотой и слабым гидроксидом, (1-я ступень): а) диссоциация молекулы электролита на ионы CuSO4 ® Cu2+ + SO42- б) краткое ионно-молекулярное уравнение гидролиза Cu2+ + HOH «CuOH+ + H+ в) полное ионно-молекулярное уравнение Cu2+ + SO42- + HOH «CuOH+ + H+ + SO42- г) полное молекулярное уравнение 2 CuSO4 + 2H2O «(CuOH)2SO4 + H2SO4. Гидролиз по катиону приводит к связыванию гидроксид-ионов воды и накоплению ионов водорода, образуя кислую среду (рН < 7). Константа гидролиза Кг равна КВ Кг = -------------------, (7.1) К2 (Cu(OH)2)
где КВ – ионное произведение воды, равное 10-14, (моль/л)2; К2 (Cu(OH)2) – константа диссоциации слабого гидроксида по последней ступени. рН раствора можно рассчитать по формуле: рНг = - ½ lg Kг – ½ lg CВ . (7.2) СВ - молярная концентрация соли, моль/л.
Гидролизу подвергаются также соли, образованные слабой кислотой и сильным гидроксидом, 1 ступень: а) К2SO3 ® 2К+ + SO32- б) SO32- + HOH «HSO3- + OH– в) 2К+ + SO32- + HOH «HSO3- + OH – + 2К+ г) К2SO3 + НОН «КHSO3 + КOH. Гидролиз по аниону приводит к связыванию ионов водорода воды и накоплению гидроксид-ионов, создавая щелочную среду (рН> 7). Константа гидролиза равна КВ Кг = -------------------, (7.3) К2 (Н2SO3) где К2 (Н2SO3) – константа диссоциации слабой кислоты по последней ступени. рОН раствора можно рассчитать по формуле
рОНг = - ½ lg Кг – ½ lg CВ, (7.4) рНг = 14 – рОНг. (7.5)
Гидролизу подвергаются также соли, образованные слабой кислотой и слабым гидроксидом, 1 ступень (молекулярное уравнение): (NH4)2CO3 + H2O «NH4OH + NH4 HCO3. Ионно-молекулярное уравнение NH4+ + CO32- + H2O «NH4OH + HCO3-. рН среды определяется относительной силой кислоты и гидроксида.
Если: Ккисл. ≈ Кгидр. - среда нейтральная; Ккис. > Кгидр. - среда слабокислая; Ккисл. < Кгидр. - среда слабощелочная.
В реакцию с водой вступают катионы слабых гидроксидов и анионы слабых кислот. Если эти ионы многозарядны (Fe+3, Cu+2, CO3-2, SiO3-2 и др.), то в результате гидролиза образуется гидроксокатион (МеОН)+ или гидроанион (НR)- (первая ступень гидролиза). Гидролиз солей, как равновесный процесс, характеризуется константой гидролиза Кг и степенью гидролиза h. Степень гидролиза есть отношение числа гидролизованных молекул к общему числу растворенных молекул соли. Степень гидролиза рассчитывается из соотношения: Кг h = -----. (7.6) СВ Глубина протекания процесса определяется природой соли. Степень гидролиза зависит от природы соли, температуры и концентрации раствора. Количественной мерой гидролиза, как и любого химического взаимодействия, является работа реакции гидролиза или изменение энергии Гиббса: ∆r Go = ∆r Ho - T ∆r So = RT ln Кг (7.7)
Кг = е или Кг = 10 (7.8)
В практической деятельности инженера сельскохозяйственного профиля необходимы знания о процессе гидролиза. Например, при внесении минеральных удобрений в почву может измениться и ее кислотность, которая оказывает большое влияние на развитие растений и почвенных микроорганизмов, на скорость и направленность химических и биохимических процессов в ней. Установлена связь между урожаем и концентрацией ионов водорода в почве. Картофель дает хороший урожай при pH = 5,0 ¸ 5,5, для овса оптимально pH = 5,3 ¸ 5,8, а при pH = 4,3 он гибнет. Из кислых почв растения легко поглощают радиоактивный Cs-137 и другие радионуклиды. Реакция среды имеет важное значение в электролитических процессах, при коррозии металлов и др. Цель работы 1. Закрепить торетические знания по химизму гидролиза. 2.Приобрести навыки определения реакции среды (рН) экспресс-методом по универсальной индикаторной бумаге и с помощью рН-метра. Опыт 1. Определение реакции среды в результате гидролиза солей: а) хлорида алюминия; б) карбоната натрия. Выполнение опыта Каплю испытуемого 0,5н. раствора нанести на универсальную индикаторную бумагу. Полученную окраску сравнить со шкалой цветов и установить величину pH. Наблюдения и выводы Результаты исследований занести в таблицу 7.1
Таблица 7.1
2. Написать молекулярные и ионно-молекулярные (полное и сокращенное) уравнения реакций гидролиза данных солей по первой ступени. 3. Назвать полученные при гидролизе (по I ступени) вещества. Опыт 2. Совместный гидролиз двух солей Выполнение опыта В пробирку внести 6-8 капель 0,5н. раствора карбоната натрия, добавить столько же 0,5н. раствора хлорида алюминия. Наблюдения и выводы 1.Отметить выделение пузырьков газа и выпадение осадка. 2.Написать молекулярное и ионные уравнения совместного гидролиза. 3.Что происходит при растворении в воде солей, образованных слабым гидроксидом и слабой кислотой? 4.Почему в таблице растворимостей напротив таких солей стоит прочерк? 5.Определить реакцию среды, используя константы диссоциации, образовавшихся слабых электролитов: KII(H2CO3)=4,7×10-11; KIII(Al(OH3))=1,4×10-9. Опыт 4. Определить реакцию среды (pH) в растворах солей: NH4NO3, Na3PO4, KCl, являющихся удобрениями, с помощью pH-метра Выполнение опыта В стакан ёмкостью 50см3 налить 40см3 0,1н. раствора нитрата аммония NH4NO3. Перед определением pH – электроды ополоснуть 2-3 раза дистиллированной водой.
Определить по шкале ориентировочное значение рН раствора, а затем перейти на более чувствительный диапазон измерений.
См. схему 7.1 установки для потенциометрического измерения рН растворов
Рис.7.1. Схема установки для потенциометрического определения рН растворов
1 - термометр; 2 - палочка для перемешивания раствора; 3 - стеклянный электрод; 4 - хлорсеребряный электрод; 5 - стакан с раствором соли; 6 -pH-метр.
Определить таким же способом pH 0,1н. растворов фосфата натрия Na3PO4 и хлорида калия KCl. Наблюдения и выводы 1. Записать результаты значений pH для исследуемых растворов (оформить в виде таблицы).
2. Рассчитать ошибки: абсолютную (истинное значение рН взять у преподавателя) и относительную.
3. Сделать вывод о характере реакции среды в растворах данных солей.
4. Написать молекулярные и ионно-молекулярные реакции гидролиза данных солей по I ступени. Назвать полученные при гидролизе вещества.
5. Какую из данных солей можно вносить для нейтрализации кислой почвы? ЛАБОРАТОРНАЯ РАБОТА № 8 Определение жёсткости воды
Жёсткость – один из технологических показателей, принятых для характеристики состава и качества воды. Жесткость воды определяется содержанием в ней растворимых солей кальция и магния. Различают жесткость карбонатную (временную) Жк, обусловленную содержанием в воде гидрокарбонатов Са(НСО3)2, Мg(НСО3)2, и некарбонатную (постоянную) жесткость Жн, которая определяется присутствием в природной воде сульфатов и хлоридов кальция и магния CaSO4, MgSO4, CaCl2, MgCl2. Общая жесткость воды Жо равна сумме карбонатной и некарбонатной жесткости:
Жо = Жк + Жн. (8.1)
Жесткость воды определяется молярной концентрацией эквивалентов ионов Са2+, Mg2+ в миллимолях на литр воды (ммоль/л): mB mB Ж = ------------- + --------------, (8.2) Mэ(В1) V Mэ(В2) V где mB1, mB2 - массы двухзарядных катионов металлов в воде, мг; Mэ(В1), Mэ(В2) – молярные массы эквивалентов катионов металлов, ммоль/л; V – объем воды в литрах. По значению жесткости природную воду различают как: - очень мягкая – Жо до 1,5ммоль/л; - мягкая – Жо от 1,5 до 4 ммоль/л; - средняя жесткость – Жо от 4 до 8ммоль/л; - жесткая – Жо от 8 до 12 ммоль/л; - очень жесткая – Жо свыше 12 ммоль/л.
Жесткость воды (Жо) хозяйственно-питьевых водопроводов не должна превышать 7ммоль/л. Вода, содержащая большое количество солей, обусловливающих жесткость, непригодна для производственных нужд; применение жесткой воды для питания паровых котлов приводит к образованию накипи на стенках, что уменьшает теплоотдачу и приводит к аварии. Для умягчения воды применяют следующие методы: - термический, - реагентный, - ионообменный, - комбинированные. На первом этапе умягчения применяют методы осаждения: термический или реагентный, а на втором этапе для более глубокой очистки – методы ионного обмена. Термический метод основан на нагревании воды до кипения, при этом происходит образование осадка СаСО3. Са(НСО3)2 ® СаСО3¯ + СО2 + Н2О. При наличии в воде гидрокарбоната магния Mg(HCO3)2 процесс перехода в осадок при кипячении происходит в несколько стадий: вначале образуется хорошо растворимый карбонат магния: Mg(HCO3)2 = MgCO3 + СО2 + Н2О. Эта соль при продолжительном кипячении подвергается гидролизу с образованием малорастворимого гидроксида магния: MgCO3 + 2 Н2О = Mg(OН)2¯ + СО2. Кипячением снижается карбонатная жесткость, однако полностью ее устранить невозможно. При умягчении с помощью реагентов вода обрабатывается веществами, связывающими ионы Са2+ и Mg2+ в практически нерастворимые вещества. В качестве реагентов применяют гидроксид кальция (гашеную известь), карбонат натрия (кальцинированная сода), ортофосфат натрия и др. Известь является одним из наиболее дешевых реагентов. Процесс умягчения воды известкованием основан на реакции: Са(НСО3)2 + Са(ОН)2 ® 2СаСО3¯ + 2Н2О. Для улучшения осаждения СаСО3 в воду добавляют коагулянт: FeCl2 или FeSO4. Находит применение известково-содовый метод (Са(ОН)2 + Na2CO3) и содово-натриевый метод (Na2CO3 + NaOН), дающие хорошие результаты. Наиболее полное умягчение воды происходит в результате применения в качестве реагента ортофосфата натрия Na3РO4, т.е. при фосфатном методе умягчения. Фосфат-ионы РO43- связывают ионы Са2+ и Мg2+ в практически нерастворимые фосфаты: 3Са2+ + 2РO43- = Са3(РО4)2¯; 3Мg2+ + 2РO43- = Мg3(РО4)2.
При умягчении воды методом ионного обмена используются иониты (катиониты и аниониты), способные связывать содержащиеся в воде ионы, которые необходимо удалить. В качестве катионитов используют алюмосиликаты типа Na2Al2SiO8 nH2O (или кратко – Na2R). При пропускании жесткой воды через слой катионита ионы натрия катионита обмениваются на ионы кальция и магния жесткой воды: Na2R + Ca2+ (Mg2+) = CaR (MgR) + 2Na+. (8.3) Цель работы 1. Определить общую и временную жесткость исследуемой воды. 2. Закрепить знания по способам умягчения воды.
Опыт 1. Определение общей жёсткости воды методом комплексоно-метрического титрования Общую жесткость воды определяют титрованием воды раствором трилона Б (комплексон III), который представляет собой двузамещенную натриевую соль этилендиаминтетрауксусной кислоты. Он способен образовывать прочные внутрикомплексные соединения (комплексонаты) с ионами Ca2+ и Mg2+. Раствор комплексоната Ш окраски не имеет. Образование комплексоната кальция при титровании жёсткой воды комплексоном Ш можно представить схемой 8.1:
Схема 8.1. Образование комплексоната кальция при титровании жесткой воды комплексоном III (трилоном Б)
Образующиеся комплексонаты кальция и магния не имеют окраски. Для смещения равновесия вправо, т.е. в сторону образования комплексоната, необходимо связать образующиеся ионы водорода. Это достигается введением аммиачного буферного раствора (NH4Cl + NH4OH), имеющего pH=10. В качестве индикатора при определении общей жёсткости применяют: эриохромчёрный Т или кислотный хром синий К (при жёсткости менее 0,05 ммоль/л). Находящиеся в жёсткой воде, ионы Ca2+ и Mg2+ образуют с индикатором в щелочной среде (pH=8÷11) соединения розового цвета. При титровании комплексоном Ш ионы Ca2+ и Mg2+ прочно связываются с ним, образуя комплексонаты, а свободный индикатор окрашивается в голубой цвет. Выполнение опыта 1.Заполнить бюретку, закреплённую в штативе, 0,1н. раствором комплексона Ш, приготовленным из фиксанала. 2.В коническую колбу, емкостью 250-300см3, налить 100см3 анализируемой воды, отмеренной мерным цилиндром. 3.Добавить в коническую колбу к исследуемой воде: а) 2,5-3см3 аммиачного буферного раствора, отмеренного мерным цилиндром; б) 3-4 капли индикатора кислотного хром синего К или несколько кристалликов (на кончике микрошпателя) эриохромчёрного Т.
4.Титрование проводить из бюретки медленно, по каплям, при постоянном перемешивании содержимого колбы, приливая к исследуемой пробе воды 0,1н. раствор комплексона Ш. Переход розовой окраски индикатора в голубую означает окончание титрования. Наблюдения и выводы 1.Результаты титрования занести в таблицу 8.1. Таблица 8.1
Титрование провести три раза. Результаты титрований должны иметь ΔV=0,1см3. Рассчитать средний объем V2 (Vср.) трилона Б, пошедший на титрование.
2. Общую жёсткость воды рассчитать по формуле (ммоль/л): V2 Сэ 1000 Жо = -------------------. V1 Результат вычисления записать в таблицу Опыт2. Определение карбонатной (временной) жёсткости воды Определение карбонатной жёсткости основано на связывании ионов HCO3- кислотой в присутствии метилоранжа – кислотно-основного индикатора, изменяющего свою окраску от красной при pH<3,1 до жёлтой при pH>4,4. В точке перехода метиловый оранжевый имеет оранжевую окраску. Анион HCO3- в воде гидролизуется: HCO3- + H2O ←→ H2CO3 + OH-; (pH>7) (8.5) Поэтому при условиях Жк > 0 вода имеет щелочную реакцию среды и метиловый оранжевый в ней окрашен в жёлтый цвет. При титровании 0,1н. раствором HCl такой воды протекает реакция нейтрализации: OH- + H+ → H2O (8.6) Ионы Н+ нейтрализуют количество ионов ОН-, эквивалентное концентрации иона HCO Молекулярное уравнение реакции при титровании: Ме(НСО3)2 + 2НСl = MeCl2 + 2CO2 + 2H2O. (8.7)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 816; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.011 с.) |


 ( 8.4)
( 8.4)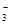 .
.


