
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет стандартного электродного потенциала. Уравнение НернстаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:
• Aox + n·e− → Ared, то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста. Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар
Если реакция идет при нормальных условиях, то
&7 Основы термодинамики Химическая термодинамика — раздел физической химии, изучающий процессы взаимодействия веществ методами термодинамики. Основными направлениями химической термодинамики являются: • Классическая химическая термодинамика, изучающая термодинамическое равновесие вообще. • Термохимия, изучающая тепловые эффекты, сопровождающие химические реакции. • Теория растворов, моделирующую термодинамические свойства вещества исходя из представлений о молекулярном строении и данных о межмолекулярном взаимодействии. Первый закон термодинамики Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника. Существует несколько формулировок первого начала термодинамики В любой изолированной системе запас энергии остаётся постоянным. Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики/ Первое начало термодинамики При изобарном процессе
при изохорном процессе
при изотермическом процессе
Основные понятия Система - любая физически или мысленно выделенная часть окружающей среды.Все, что находится вне системы, называется внешней средой. По способности обмена с внешней средой системы делятся на: Изолированные - не обмениваются с внешней средой ни энергией, ни веществом. Закрытые - обмениваются с внешней средой энергией, но не веществом. Открытые - обмениваются с внешней средой и энергией, и веществом. Теплота (энтальпия) Превращения энергии при химических реакциях. Химические реакции протекают с выделением или с поглощением энергии. обычно эта энергия выделяется или поглощается в виде теплоты. Выделение теплоты при взаимодействии различных веществ заставляет признать, что эти вещества еще до реакции в скрытой форме обладали определенной энергией. Такая форма энергии, скрытая в веществах и освобождающаяся при химических, а также при некоторых физических процессах (например, при конденсации пара в жидкость жгли при кристаллизации жидкости), называется внутренней энергией вещества При некоторых реакциях наблюдается выделение или поглощение лучистой энергии. Обычно в тех случаях, когда при реакция выделяется свет, внутренняя энергия превращается в излучение не непосредственно, а через теплоту. Но известны процессы, в коде которых внутренняя энергия превращается в лучистую непосредственно. Эти процессы носят название холодного свечения или люминесценции. Большое значение имеют процессы взаимного превращения внутренней и электрической энергии. При реакциях, протекающих со взрывом, внутренняя энергия превращается в механическую – частью непосредственно, частью переходя сперва в теплоту. Но известны процессы, в коде которых внутренняя энергия превращается в лучистую непосредственно. Эти процессы носят название холодного свечения или люминесценции. Итак, при химических реакциях происходит взаимное превращение внутренней энергии веществ, с одной стороны, и тепловой, лучистой, электрической или механической энергии, с другой. Реакции, протекающие с выделением энергии, называют экзотермическими, а реакции, при которых энергия поглощается, эндотермическими. Энтропия Энтропия— в естественных науках мера беспорядка системы, состоящей из многих элементов. Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом Вероятность различных состояний вещества (газ, кристаллическое, жидкое) можно описать как некоторое его свойство и количественно выразить значением энтропии S [в Дж/(К*моль)] Зависимость энтальпии и энтропии от температуры
7.3. Закон Гесса (открыт в 1840) Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадии процесса
Практически значимое следствия закона Гесса • Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа). • Тепловой эффект химической реакции равен сумме теплот образования образующихся веществ за вычетом суммы теплот образования исходных веществ умноженные на их стехиометрические коэффициенты. • Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю Энергию Гиббса Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.) Понятие энергии Гиббса широко используется в термодинамике и химии. Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж) В химических процессах одновременно действуют два противоположных фактора — энтропийный (
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При Обратите внимание, что речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 552; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.24.148 (0.007 с.) |








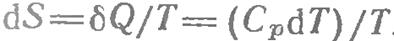



 ) и энтальпийный (
) и энтальпийный ( ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (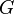 ):
):
 процесс может протекать, при
процесс может протекать, при  процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же  , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.


