
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила техники безопасности в учебном процессеСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Занятие №1 Тема: «Техника микроскопии и приготовления гистопрепаратов» Цели занятия: 1. Ознакомиться с правилами техники безопасности в учебном процессе и организацией рабочего места студента-гистолога. 2. Ознакомиться с содержанием основных этапов изготовления фиксированного и окрашенного гистологического препарата 3. Получить представление о тинкториальных свойствах структур в гистологическом препарате. 4. Ознакомиться с использованием общих или специальных методов выявления изучаемых структур. 5. Ознакомиться с правилами оформления лабораторной работы. Приготовление тотальных препаратов В некоторых случаях объект исследуют целиком без приготовления срезов и, следовательно, без предварительного уплотнения. Обычно такими объектами являются тонкие структуры – серозные, мозговые, зародышевые оболочки, тонкостенные сосуды и т. д. Препараты объектов, исследуемых целиком, называются тотальными. При изготовлении тотальных препаратов сальника, брыжейки, мозговых оболочек из них вырезают кусочки и опускают в фиксатор. При изучении зародышевых оболочек можно ввести фиксатор шприцем в амнион. Если орган может при фиксации изменить свою форму и деформировать покрывающую его оболочку (например, серозную оболочку передней брюшной стенки), его прикалывают стеклянными иглами оболочкой вверх к пластинке пробки и опускают в фиксатор объектом вниз. При исследовании сосуда фик Окрашивание и заключение тотальных препаратов производятся так же, как ненаклеенных целлоидиновых и замороженных срезов. Методы исследования Современная гистология располагает большим арсеналом средств для изучения биологических структур на всех уровнях их организации – клеточном, тканевом, органном. Основными объектами исследования являются гистологические препараты или их фотографии, классическим методом – микроскопирование. Световая микроскопия наиболее распространенный способ изучения гистологических структур. Современные биологические микроскопы дают максимальное (до 2500 раз) увеличение (произведение увеличения объектива на увеличение окуляра). Люминесцентная микроскопия позволяет наблюдать флуоресценцию (свечение) ряда веществ и структур, возбуждаемую ультрафиолетовыми и сине-фиолетовыми лучами спектра. Флуоресцентная микроскопия является методом прижизненного наблюдения клеток. Она позволяет не только рассмотреть ряд структур в них, но и определить их химический состав. Электронная микроскопия – это метод изучения субмикроскопических структур клетки. В электронном микроскопе роль линз выполняют электромагниты, фокусирующие пучок электронов на препарат. Объект рассматривают на светящемся экране или фотографируют. Разрешающая способность электронного микроскопа примерно в 100 раз больше, чем светового, что дает возможность исследовать клеточные структуры на молекулярном уровне. Цитохимические методы позволяют выяснить химическую природу клеточных структур и характер распределения тех пли иных веществ в клетке. Разработаны методы цитохимического анализа основных соединений, входящих в состав структур клетки (белков, нуклеиновых кислот, углеводов, ферментов). Задание 1. Изучить устройство светового микроскопа, являющегося постоянным рабочим инструментом при изучении курса гистологии и записать в тетрадь основные его части. Научиться пользоваться микроскопом. Микроскоп – оптический прибор, предназначенный для изучения прозрачных объектов, невидимых простым глазом. В световых биологических микроскопах различают две основные части: механическую и оптическую (рис. 5А).
Рис.5. Микроскоп для биологических исследований. Механическая часть: 1 – основание; 2 – тубусодержатель 3 – тубус; 4 – коробка механизма микроподачи; 5 – револьверное устройство; 6 – предметный столик с зажимами-клеммами; 7 – макрометрический винт (кремальера); 8 – микрометрический винт; 9 – винт конденсора. Оптическая часть: 10 – окуляр (с различной степенью увеличения ×5, ×7, ×10, ×15); 11 – объективы (рис. 5.Б): а) малого увеличения (×8) б) большого увеличения (×40) в) иммерсионного увеличения (×90) «Сухие» объективы работают в обычных условиях – без дополнительных маркировок; иммерсионные объективы работают при наличии иммерсии – с дополнительными маркировками в виде полос. Цвет полосы показывает природу иммерсии: чёрная полоса – иммерсия масленая, белая полоса – иммерсия водная. С оптической частью связано осветительное устройство, которое включает в себя: 12 – конденсор с ирисовой диафрагмой; 13 – зеркало с двумя поверхностями – вогнутой и плоской. Правила пользования микроскопом: 1. Удобно поставить микроскоп на столе. 2. Револьвер замкнуть на засечку, поставив при этом объектив малого увеличения – 8. Фокусное расстояние должно быть при этом около 1 см от объектива. 3. Установить освещение при малом объективе, повернув вогнутое зеркало к источнику света так, чтобы поле зрения было освещено равномерно и достаточно хорошо. 4. Положить препарат на предметный столик, чтобы покровное стекло гистологического препарата было сверху. 5. Рассмотреть препарат при слабом увеличении. Найти нужный участок для последующего детального изучения и поставить его в центр поля зрения микроскопа. Препарат закрепить зажимами и повернуть револьверное устройство на сильный объектив до щелчка. 6. Очень осторожным движением винта кремальеры «на себя» установить фокус сильного увеличения и микровинтом отфокусировать объект (фокусное расстояние около 1-2 мм). 7. Рассмотреть препарат при сильном увеличении, периодически вращая микрометрический винт в обе стороны на четверть оборота для того, чтобы лучше просмотреть глубокие слои изучаемого препарата. 8. Изучить препарат, зарисовать и обозначить. По окончании изучения и зарисовки препарата следует поднять тубус, перевести револьвер на слабое увеличение и только тогда освободить зажимы и снять препарат со столика микроскопа. При малом увеличении конденсор должен быть опущен, а при большом – поднят. Приготовить окулярную указку для микроскопа. Вынуть окуляр и снять его наружные размеры, т. е. изобразить на плотной бумаге (альбомный лист) в виде круга. Внутренние размеры определить по световой линзе. Затем вырезать кольцо. К его поверхности приклеить волос по радиусу центрального поля. После проверки преподавателем правильности изготовления указки поместить ее между линзами окуляра. Для этого отвернуть (против часовой стрелки.) глазную линзу, вставить указку и завернуть линзу обратно. Типы микроскопов
Биомед · ЛОМО · Olympus · Nikon Учебные · Лабораторные · Исследовательские
Таблица 1. Прямые микроскопы
Простые лабораторные бинокулярные микроскопы предназначены для биологических, биохимических, патологоанатомических, цитологических, гематологических, урологических, дерматологических и общеклинических исследований.
Рис.8. Микроскоп СХ 21 (Olympus) – компактный микроскоп с высоким качеством оптики, предназначен для лабораторий общеклинических исследований, идеален для лабораторий с ограниченным рабочим местом, бинокуляр, скорректированная на бесконечность оптика.
Таблица 2. Люминесцентные микроскопы
Рис.9. Микроскоп Биомед 2Л
Люминесцентные микроскопы предназначены для иммунологических исследований с применением флюоресцирующих и ферментных меток, а также гистологических и цитологических исследований в клинической лабораторной диагностике.
Таблица 3. Поляризационные микроскопы
Поляризационные микроскопы предназначены для исследований непрозрачных объектов в отраженном свете, обыкновенном и поляризованном, а также прозрачных объектов в проходящем свете. Области применения: петрография, минералогия, кристаллография, углепетрография, биология, медицина, химия, криминалистика.
Рис.10. Микроскоп Полам Р – 312 (ЛОМО) Таблица 4. Инвертированные микроскопы
Инвертированные микроскопы предназначены для исследования клеточных культур, находящихся в специальной лабораторной посуде. Области применения: иммунология, биотехнология, бактериология, фармакология, биология, сельское хозяйство, экология.
Рис.11. Биолам П2-1 (ЛОМО)
Таблица 5. Стереомикроскопы
Стереомикроскопы предназначены для наблюдения прямого объемного изображения предметов в отраженном или проходящем свете при естественном или искусственном освещении. Микроскопы применяются в криминалистике, биологии, медицине, минералогии, археологии, машиностроении, приборостроении и других областях науки и техники. Микроскопы могут комплектоваться осветителями светлого поля, темного поля, косого света, отраженного света и люминесцентным осветителем.
Рис. 12. Микроскоп Биомед МС-1 Материалы Таблица 6. Получение слабых спиртов
Приготовление эозина Эозин – это кислый краситель, окрашивающий цитоплазму клетки. 0,1 грамм или 500 мг эозина смешиваем с 100 мл дистиллированной водой (спиртовой раствор 0,1 %). Простые фиксаторы Формалин (формол) является самым дешевым и распространенным фиксатором. В чистом виде представляет, светлую, сильно пахнущую жидкость, состоящую из 40% водного раствора формальдегида. Применяется преимущественно в виде 10-20% водного раствора, для чего 1 часть неразведенного формалина разводят 9 или 4 частями воды. Приготавливают раствор обязательно на водопроводной воде, так как дистиллированная вызывает набухание тканей. Широкое применение формалин получил благодаря ряду свойств: а) высокой степени диффузии; б) способности хорошо сохранять форму, окраску и структуру исследуемого объекта; в) оказывать длительное фиксирующее действие (до нескольких лет), существенно не ухудшая при этом качество материала; г) хорошо сохранять жиры и липоиды.
Срок фиксации тканей в формалине 24-48 часов. Обычный формалин, как правило, содержит примесь метилового спирта и муравьиной кислоты, количество которой увеличивается под влиянием света. При охлаждении формалина в растворе появляется муть, оседающая в виде белого осадка (параформальдегид). Такой же осадок наблюдается на стенках сосуда и при испарении формалина. Поэтому формалин следует хранить в темной плотно закрывающейся стеклянной посуде, при температуре не ниже 9°С. Нейтрализация формалина.Примесь в формалине муравьиной кислоты придает раствору слабокислый характер, что нежелательно при применении ряда методов исследования (некоторые гистохимические реакции, серебрение раствором азотнокислого серебра). Способ нейтрализации формалина довольно прост: в сосуд засыпают углекислый кальций (или углекислую магнезию) в таком количестве, чтобы на дне образовался слой толщиной 1,5-2 см. Затем наливают формалин, несколько раз энергично встряхивают и оставляют стоять 24-48 часов. В течение этого времени происходит нейтрализация раствора. Побочные действия формалина. Длительное хранение препаратов в концентрированном растворе формалина придает тканям чрезмерную плотность, затрудняющую дальнейшую обработку и ухудшающую качество препарата. Устранение этого недостатка' возможно путем помещения материала на 2 недели в 1 % раствор азотнокислого серебра или 10% раствор лимонной кислоты. Длительное хранение в 10% растворе формалина приводит также к набуханию объекта, что необходимо помнить при его измерении после фиксации. При фиксации формалином в препаратах нередко появляется темно-коричневый кристаллический осадок – результат взаимодействия формалина с находящимся в тканях гемоглобином. Его удаляют путем помещения неокрашенных срезов в 1-5% раствор нашатырного спирта или 70° этиловый алкоголь на различные сроки (от 5 минут до 4 часов). Затем препарат тщательно промывают и ведут дальнейшую обработку. Следует постоянно помнить, что длительное действие паров формалина сильно раздражает слизистые оболочки. Смачивание кожи формалином оказывает дубящий эффект, а при повторных частых контактах вызывает сухую экзему. Поэтому перед препарированием формалиновые препараты помещают в слабо аммиачную воду (для устранения запаха) и работают в резиновых перчатках. Этиловый спирт. Фиксирующее действие осуществляется за счет отнятия у тканей воды и коагуляции белков. Несмотря на ряд отрицательных свойств спирта (сморщивание клеток в результате быстрого отнятия воды, растворение и экстракция жиров и гемоглобина), он как фиксатор находит широкое применение в микроскопической технике. Это объясняется тем, что этиловый спирт осуществляет быструю фиксацию, не требующую после себя обезвоживания тканей перед заливкой в парафин и целлоидин. Будучи химически неактивным веществом, спирт особенно пригоден при гистохимических исследованиях. В нем полностью сохраняются такие вещества, как муцины, гликоген, мочевая кислота, железо, кальций, которые легко растворимы в других фиксирующих жидкостях. Этиловый спирт применяется чаще в виде 96° и абсолютного спирта. Некоторые авторы рекомендуют также концентрации 80 и 90°. Время фиксации зависит от материала: для тонких пленок 15-30 минут, для кусочков толщиной 3-4 мм -2-4 часа. В связи с тем что спирт легче воды, последняя, экстрагируясь из тканей, опускается на дно. Поэтому под кусочки исследуемого материала нужно обязательно подкладывать толстый слой ваты. Излишнее пребывание препарата в спирте вызывает чрезмерное уплотнение ткани, что плохо отражается на последующей ее обработке. Метиловый спирт (метанол). Бесцветная жидкость, в чистом виде напоминает по запаху этиловый спирт, технический же (неочищенный) метанол обладает неприятным запахом, обусловленным примесью других веществ. В микроскопической технике применяется в виде абсолютного, лишенного примесей спирта, для фиксации мазков крови. Лучше всего пользоваться метанолом, предназначенным для анализа. Следует помнить, что метанол является сильным ядом и требует соблюдения правил употребления и хранения, предусмотренных для ядовитых веществ группы А. Промывание Эта процедура преследует цель освобождения исследуемого объекта от излишнего количества фиксатора. Способ промывки зависит от методики фиксации. Например, после фиксирующих смесей, содержащих пикриновую кислоту, сулему, трихлоруксусную кислоту, применяют этиловый спирт разной концентрации (см. предыдущий раздел). После фиксации в формалине, в жидкостях, содержащих хром, осмиевую кислоту, обычно употребляют воду. В подавляющем большинстве случаев промывку кусочков тканей производят в проточной водопроводной воде. Наиболее удобно это делать, помещая объект в стеклянные или фарфоровые сита (рис.15), которые закрывают пробкой и опускают в сосуд с проточной водой. Пробка обеспечивает плавучесть, а отверстие – постоянную циркуляцию воды. Если кусочек не прошит ниткой, то этикетку также помещают в сито.
Рис.15. Промывка материла после фиксации
При отсутствии сита кусочек заворачивают в марлю и подвешивают за нитку в сосуд, наполненный водой. Вверх сосуда закрывают марлей и проделывают в ней небольшое отверстие. На водопроводный кран натягивают резиновый шланг или привязывают шнур (полоску бинта), свободный конец которого пропускают через марлю в сосуд и пускают по нему несильную струю воду. Среднее время промывки 20-24 часа. Обезвоживание Начиная с этого этапа и до самого конечного момента приготовления гистологического препарата, следует строго придерживаться правила постепенного воздействия применяемых веществ на исследуемые ткани. Несмотря на то, что большинство фиксаторов в процессе своего действия уплотняют материал, этого уплотнения недостаточно для изготовления срезов. После промывки кусочки подвергают дальнейшему уплотнению путем обезвоживания в спиртах увеличивающейся концентрации. Для проведения процедуры приготавливают необходимое количество бюксов или стаканчиков с притертыми крышками, этикетируют их и заливают спиртами: 50, 60, 70, 80 и 96° (два стаканчика), 100° (два стаканчика). Такой последовательный ряд сосудов получил название гистологической батареи. Спирты нужной крепости приготавливают заранее по специальной таблице разведения (табл. 2) из 96° спирта (для того чтобы приготовить 100 мл спирта крепостью 60°, необходимо взять 63 мл 96° спирта и 37 мл дистиллированной воды и т.д.). Способ приготовления абсолютного спирта. Обычный спирт-ректификат содержит 96% чистого спирта и 4% воды. Для того чтобы получить абсолютный спирт; необходимо извлечь эту воду. Наиболее распространенным способом является обезвоживание при помощи прокаленного медного купороса (сернокислая медь). В основе этого метода лежит свойство медного купороса отдавать и присоединять молекулы воды, меняя при этом, свой цвет (прокаленная сернокислая медь имеет вид серовато-белого порошка, который по мере присоединения воды приобретает синюю окраску). Насыпав порошок прокаленного медного купороса (примерно 10 г на 100 мл спирта) в чистую стеклянную бутылку с притертой пробкой, наливают туда же 96° спирт. Затем бутылку встряхивают до равномерного распределения порошка. Подобную процедуру повторяют на протяжении 1-2 дней. По мере поглощения воды порошок приобретает синюю окраску. Однократная обработка, как правило, не дает обезвоживания, поэтому спирт переливают в другой сосуд, содержащий свежую порцию сернокислой меди. Подобную процедуру повторяют до тех пор, пока осадок не перестанет приобретать голубой цвет. Обезвоженный спирт отфильтровывают в чистую посуду, которую плотно закрывают. Желательно проверить рН абсолютного спирта, так как после обработки медным купоросом он может стать слегка подкисленным. Для нейтрализации достаточно прибавить небольшое количество карбоната кальция (СаСО3). Если в лаборатории нет фабричного порошка безводного медного купороса, то его можно приготовить самим, прокалив кристаллическую соль над огнем в широкой фарфоровой чашке (до тех пор, пока из синих кристаллов не образуется белый порошок). Для равномерного прокаливания необходимо перемешивать купорос стеклянной палочкой. Нельзя допускать почернения (особенно заметного по краям чашки), свидетельствующего о перекаливании. Таким Следует помнить, что порошок медного купороса сильно раздражает слизистые оболочки. Прокаливание нужно проводить в вытяжном шкафу или же защищать слизистые оболочки носа и рта обычной марлевой маской. Испытание абсолютного спирта на содержание воды производят опусканием в него нескольких зерен карбида кальция. Появление характерного запаха ацетилена и помутнение свидетельствуют о наличии воды. Более грубый способ – прибавление нескольких капель абсолютного спирта к 4-5 мл бензола или ксилола. Помутнение жидкости указывает на то, что спирт содержит около 3% воды. Если препарат промывали в воде, то обезвоживание начинают с 50° спирта, если же в спиртах (после жидкости Ценкера и др.), то объект помещают в спирт последующей крепости (из 70° в 80° и т. п.). При тонких цитологических исследованиях обезвоживание начинают с 10-20° спирта. Время пребывания кусочков в отдельных спиртах определяется их величиной и свойствами. Объекты средней величины (толщиной 5 мм) достаточно держать в слабых спиртах (до 60°) по 2-4 часа, а в более крепких от 12 до 24 часов. Мелкие и более тонкие объекты можно проводить соответственно быстрее. Для того чтобы спирт проникал в ткани равномерно со всех сторон, объект помещают на слой ваты (обычной или стеклянной) или подвешивают в стеклянном сите. При таком расположении кусочков спирт, отнимающий воду из тканей и стекающий ко дну, не мешает дальнейшему обезвоживанию. Следует помнить, что длительное пребывание объекта в спиртах низкой концентрации приводит к мацерации тканей, в то время как передержка в спиртах высокой концентрации чрезмерно уплотняет их. Поэтому, если необходимо прервать процесс обезвоживания, то материал можно оставить (на несколько дней) в «индифферентном» спирте, крепость которого составляет 70-80°. Необходимо также учитывать, что спирты в процессе обезвоживания довольно быстро загрязняются экстрагируемыми из тканей веществами и особенно жирами. Не следует использовать длительное время одни и те же спирты. Необходимо своевременно их сменять. В процессе обезвоживания могут быть ошибки: 1) переуплотнение при полном обезвоживании, 2) нормальное уплотнение при недостаточном обезвоживании. Оба эти недостатка являются следствием несоблюдения оптимальных условий обезвоживания и отрицательно сказываются на дальнейшей обработке материала. Достижение хороших результатов дается только опытом, поэтому необходимо тщательно регистрировать все этапы и внимательно анализировать результаты (особенно при освоении методов). Перед тем как перенести объект в 96° или абсолютный спирт, следует придать кусочку окончательную форму и размеры (обрезать поврежденные или излишние участки). Для полного обезвоживания следует проводить материал последовательно через две порции абсолютного спирта (по 12-24 часа). Пропитывание и заливка Приготовление высококачественных гистологических препаратов требует наличия равномерно тонких срезов с исследуемого объекта. Для того чтобы их получить, кусочки тканей надо пропитать и залить такой средой, которая превратила бы их в хорошо режущуюся массу. Следует помнить, что процесс пропитывания и заливки исследуемого материала требует большой тщательности. Незнание основных принципов и несоблюдение необходимых условий может привести к тому, что объект окажется непригодным для резки или полученные срезы будут некачественными. Наиболее употребительными для этих целей материалами являются парафин, целлоидин и желатин.
Этот метод широко распространен в исследовательских гистологических лабораториях благодаря относительной быстроте заливки (в течение 1-2 дней после обезвоживания), возможности приготовления серийных срезов, а также тонких срезов для цитологических исследований (толщина 2-3 мкм), удобству хранения блоков и неокрашенных срезов (практически неограниченное время). К недостаткам метода следует отнести значительное сжатие исследуемого материала (до 20%), вызываемое воздействием высокой температуры в процессе пропитывания парафином. Богатые водой, рыхлые ткани мало пригодны к заливке в парафин. Известное неудобство представляет необходимость удаления парафина из срезов перед их окраской. Парафин при комнатной температуре – твердое гомогенное вещество. Существует несколько сортов парафина: мягкие (точка плавления 45-54°) и твердые (точка плавления 58-60°). В большинстве случаев для заливки применяют парафин с точкой плавления 54-56°. Если резка предполагается при низкой температуре окружающей среды, то лучше применять парафин с более низкой точкой плавления (48-50°). Нужная степень твердости парафина достигается смешиванием в различных комбинациях мягких и твердых сортов. Если неизвестна точка плавления парафина, ее можно определить самому. Для этого расплавленный парафин насасывают в тонкий стеклянный капилляр и дают ему застыть. Затем очищают капилляр снаружи от приставшего парафина и вместе с градусником опускают в химический стаканчик с водой, которую начинают постепенно нагревать, перемешивая стеклянной палочкой. Как только парафин в капилляре начнет расплавляться, отмечают температуру, которая и укажет точку его плавления. Следует помнить, что обычный продажный парафин часто содержит газообразные примеси, которые при заливке образуют пузырьки, придающие парафину повышенную ломкость и значительно ухудшающие качество резки материала. Для избавления от этих примесей свежий парафин следует на длительное время оставить в расплавленном виде в плоских чашках (чтобы увеличить площадь для выделения газов) при температуре 70° (для этого можно приспособить сушильный шкаф). Можно также подвергать парафин частому расплавлению и нагреванию (до появления дыма) с последующим быстрым охлаждением. Если парафин, несмотря на соответствующую подготовку, сохраняет жесткость, к нему следует добавить чистый пчелиный воск в количестве от 2 до 5%, что придаст парафину большую эластичность. Заливка в парафин требует тщательного соблюдения двух основных условий: 1) препарат должен быть полностью обезвожен и 2) не должен содержать спирт. Первое условие, как мы уже знаем, обеспечивается в процессе обезвоживания и уплотнения в батарее спиртов повышающейся концентрации. Удаление спирта. Для удаления спирта и подготовки к пропитыванию парафином материал обрабатывают одним из растворителей парафина, обладающим способностью вытеснять спирт. К таким веществам относятся: хлороформ, бензол, толуол, ксилол, сероуглерод и др. Чаще используют хлороформ и бензол. Толуол и ксилол делают кусочки более твердыми. Следует помнить, что продажный разливной хлороформ может быть загрязнен и содержать воду, что несовместимо с требованиями, предъявляемыми к веществам, применяющимся в процессе подготовки объекта к пропитыванию. Для освобождения хлороформа от спирта и воды его настаивают длительное время над хлористым кальцием. Хранят хлороформ в темноте, так как на свету он легко разлагается. Методика пропитывания Обезвоженные и уплотненные кусочки перекладывают из абсолютного спирта в смесь абсолютного спирта с хлороформом (1:1) на 2-3 часа, а затем в чистый хлороформ, где они вначале плавают (выступая над его поверхностью), а затем по мере пропитывания постепенно погружаются. В процессе удаления спирта хлороформ меняют 2-3 раза на протяжении 1,5-3 часов (в зависимости от свойств объекта и толщины кусочков). При величине кусочка 1 × 1 его держат в хлороформе 30 минут. Затем, соблюдая принцип постепенного замещения хлороформа парафином, помещают объект в смесь из равных частей парафина (желательно мягкого) и хлороформа. Эта смесь, застывающая при комнатной температуре, при нагревании до 37° расплавляется и приобретает жидкую консистенцию. Кусочки находятся в хлороформ-парафине при 37° в течение 3-6 часов (при 56° время сокращают до 30 минут – 1 часа). При необходимости отсрочить дальнейш В целях полного освобождения объекта от хлороформа кусочки проводят последовательно через 2-3 порции расплавленного парафина. Время пребывания в парафине зависит от величины кусочков и свойств ткани. Кусочки толщиной 2-5 мм должны в общей сложности находиться в парафине от 2 до 5 часов. Если объект хорошо обезвожен и не содержит спирта, задержка в парафине не ухудшает качество объекта даже при пропитывании в течение нескольких дней. При наличии же в кусочках остатков воды и спирта результаты обработки ухудшаются прямо пропорционально длительности излишнего пребывания объекта в расплавленном парафине. Парафин для пропитывания можно применять многократно, но при этом нужно строго следить за тем, чтобы не перепутать порции парафина. Для этого бюксы (или стаканчики) необходимо обозначить соответствующими цифрами (1,2,3). Заливка После окончательного пропитывания объекта его заливают расплавленным парафином, специально приготовленным для этих целей и хранящемся в термостате. В качестве формочек для заливки используют разнообразные приспособления. Г-образные гладкие угольники (рис. 16, а) из металла (латунь, свинец, сталь). Рекомендуется применять угольники, длинная сторона которых равна 8-10 см, короткая – 3 см, высота – 1,5-2 см. Угольники кладут на отполированную металлическую или стеклянную пластину и, сдвигая углы, создают формочку нужных размеров. Бумажные коробочки изготовляют из листка плотной бумаги по схеме, представленной на рис. 16, б, где порядок номеров указывает очередность, а линии – направление сгибания листка. Удобство бумажных формочек заключается в возможности значительного варьирования их размеров, простоте маркировки (простым карандашом на стенках) и длительном хранении залитого материала.
Рис.16. Приспособления для парафиновой заливки а – г-образные металлические угольники,
Для заливки мелких объектов можно применять часовые стекла, четырехугольные фарфоровые ванночки из-под акварельной краски и другие приспособления. Заливка осуществляется следующим образом. Предназначенный для заливки парафин подогревают до 58-60° и аккуратно наливают в приготовленную формочку, заполняя ее до самых краев и избегая образования пузырьков воздуха (хорошо иметь для этих целей высокую фарфоровую кружку с ручко
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 613; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.42.189 (0.016 с.) |

 сирующего жидкость вводят на некоторое время в его просвет, затем сосуд разрезают вдоль, материал накалывают на пробку эндотелием вверх и фиксируют описанным выше способом.
сирующего жидкость вводят на некоторое время в его просвет, затем сосуд разрезают вдоль, материал накалывают на пробку эндотелием вверх и фиксируют описанным выше способом.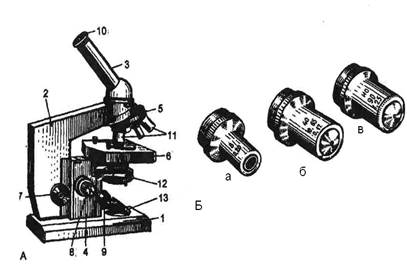








 Высокая диффузионная способность и незначительное осаждающее действие позволяют формалину довольно быстро и глубоко проникать в ткани, что позволяет фиксировать кусочки органа от 1 см и более, а при необходимости и довольно крупные органы целиком.
Высокая диффузионная способность и незначительное осаждающее действие позволяют формалину довольно быстро и глубоко проникать в ткани, что позволяет фиксировать кусочки органа от 1 см и более, а при необходимости и довольно крупные органы целиком.

 Из других фиксирующих веществ следует упомянуть ацетон, сулему, соли тяжелых металлов (ртуть, кобальт, платина, уран и т. д.) и кислоты (уксусная, трихлоруксусная, пикриновая, осмиевая, хромовая и Др.). В чистом виде эти вещества применяются редко, но зато являются составной частью многих фиксирующих смесей.
Из других фиксирующих веществ следует упомянуть ацетон, сулему, соли тяжелых металлов (ртуть, кобальт, платина, уран и т. д.) и кислоты (уксусная, трихлоруксусная, пикриновая, осмиевая, хромовая и Др.). В чистом виде эти вещества применяются редко, но зато являются составной частью многих фиксирующих смесей.

 же путем обрабатывают медный купорос, оставшийся после обезвоживания спирта.
же путем обрабатывают медный купорос, оставшийся после обезвоживания спирта.
 Заливка в парафин
Заливка в парафин


 ую обработку материала можно после погружений объекта в смесь хлороформа с парафином извлечь сосуд из термостата и оставить при комнатной температуре на ночь (или даже на несколько дней) в закрытом состоянии, а затем, вновь расплавив в термостате при 56°, перенести в рядом стоящий горячий парафин для пропитывания, Излишнее пребывание объекта в растопленном хлороформ-парафине ухудшает качество резания.
ую обработку материала можно после погружений объекта в смесь хлороформа с парафином извлечь сосуд из термостата и оставить при комнатной температуре на ночь (или даже на несколько дней) в закрытом состоянии, а затем, вновь расплавив в термостате при 56°, перенести в рядом стоящий горячий парафин для пропитывания, Излишнее пребывание объекта в растопленном хлороформ-парафине ухудшает качество резания.



