Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготовление парафиновых и целлоидиновых срезовСодержание книги Поиск на нашем сайте
Блок фиксируют в объектодержателе так, чтобы длинная ось блока располагалась вдоль длинной оси микротома, а поверхность блока горизонтальной. Очень важна правильная установка ножа. Оптимальным углом наклона ножа считается такой, когда плоскость фасетки совпадает с плоскостью среза. На практике угол наклона ножа обычно несколько больше оптимального. Если угол наклона ножа слишком велик, материал будет крошиться, если слишком мал, нож будет 1-2 раза проскальзывать над блоком, а потом срезать толстый срез. Парафиновые блоки режут прямым ножом, целлоидиновые – плосковогнутым. При резке парафиновых блоков нож устанавливают перпендикулярно оси микротома или слегка под углом. И последнем случае нельзя получить серийных срезов, но зато очень плотные и трудно режущиеся объекты режутся легче. При резке целлоидиновых срезов нож устанавливают под углом. Когда нож установлен, к нему осторожно подводят блокодержа-тель с блоком и одновременно придвигают нож к блоку. Подачу объектодержателя осуществляют с помощью кремальеры, расположенной в основании объектодержателя, либо рукой, толкая санки объектодержателя вдоль наклонных рельсов. Когда блок и нож сближены, проверяют горизонтальность верхней поверхности блока, которая не должна доходить до лезвия ножа на 0,5-1 мм. После этого устанавливают микрометрическую шкалу на получение толстых срезов (30 мкм) и движением салазок ножа начинают подавать блок вверх до тех пор, пока не начинают получаться первые полные срезы, затем микрометрическую шкалу следует установить на необходимую толщину срезов. Парафиновые срезы диаметром 7-10 мкм. При очень хорошо залитом материале и хорошо наточенном ноже можно получить срезы толщиной 3-5 мкм. Толщина целлоидиновых срезов обычно составляет 12-15 мкм. Парафиновые срезы режут сухим ножом. При резке целлоидиновых срезов поверхность ножа и поверхность блока постоянно смачивают 70% спиртом. Полученные парафиновые срезы осторожно, не прикасаясь к режущему краю ножа, снимают влажной кисточкой или препаровальной иглой и помещают в чашку с теплой водой или сразу наклеивают на предметное стекло (см. ниже). Если блоки небольшие и прямоугольные, при поперечном положении ножа при резке срезов получают ленточки (серии). Отдельные срезы не снимают с ножа. Края их прикреплены друг к другу, и они располагаются полоской друг за другом. Эту полоску снимают целиком для
Наклеивают парафиновые срезы на чистые обезжиренные предметные стекла, смазанные белком с глицерином. Для приготовления последнего свежий яичный белок взбивают шпателем и фильтруют через смоченный дистиллированной водой бумажный фильтр. К профильтрованному белку добавляют равный объем глицерина, смешивают и кладут для предупреждения загнивания 2-3 кусочка тимола величиной с зернышко пшеницы. В закрытой склянке белок с глицерином хранится длительное время. Маленькую капельку белка с глицерином наносят на предметное стекло и пальцем размазывают тонким слоем по стеклу. Если срезы были помещены в чашку с дистиллированной водой, белок на стекле коагулируют, подержав стекло над спиртовкой белком вверх. Затем расправленный срез при помощи кисточки вылавливают из воды и переносят на стекло. Осторожно наклоняя предметное стекло, дают воде стечь и затем на 12-24 ч стекло переносят в термостат с температурой 37°С. Более употребителен другой способ наклеивания и расправления парафиновых срезов. При этом на смазанное белком с глицерином предметное стекло наносят несколько капель дистиллированной воды, на которую прямо с микротомного ножа переносят срезы. Затем стекло осторожно подогревают над спиртовкой до полного расправления срезов, при этом следует избегать расплавления парафина, так как в противном случае материал портится. Излишнюю воду осторожно удаляют фильтровальной бумагой, и стекла оставляют для просушки при комнатной температуре или в термостате при 37°С. Вместо спиртовки для расправления парафиновых срезов можно использовать специальный электрический прибор «Приспособление для сушки и расправления парафиновых срезов», представляющий собой подогреваемый до нужной температуры столик. На покрытое белком стекло наносят несколько капель дистиллированной воды, кладут стекла на столик и переносят на него срез. После расправления среза лишнюю воду удаляют фильтровальной бумагой и оставляют стекло с наклеенным срезом на столике для досушивания.
Целлоидиновые срезы переносят с ножа в низкий бюкс с 70% спиртом и в дальнейшем окрашивают без наклеивания на предметное стекло, помещая срезы с помощью препаровальной иглы с загнутым концом или стеклянным крючком в соответствующие реактивы. Правила резки парафиновых блоков и некоторые способы устранения возможных недостатков заключаются в следующем. Передвигать салазки ножа нужно равномерно, не нажимая на них. Если материал крошится, то это может зависеть от слишком большого наклона ножа или от слишком тугоплавкого парафина и низкой температуры окружающей среды. Правильный угол наклона можно найти эмпирически, попробовав разные углы наклона. Устранить влияние низкой температуры можно, подышав на блок или пристроив настольную лампу таким образом, чтобы она светила на блок и слегка его согревала. Если залитый материал отделяется от парафина или выпадает из него, причина может заключаться в недостаточном удалении из материала спирта или в использовании при заливке слегка охлажденного парафина. В любом случае материал нужно поместить обратно в промежуточную среду (ксилол, хлороформ) и затем повторить заливку. Если срезы разрываются или покрываются бороздками, это означает, что на ноже есть зазубрины. Можно попробовать слегка подвинуть нож, так чтобы на блок приходился другой его участок. Если это не поможет, необходимо точить нож заново. Закручивание срезов и их прилипание к ножу встречаются при очень мягком парафине и высокой температуре окружающей среды. В этом случае перед резкой можно положить блок в холодильник, а во время резки время от времени класть на него кусочек льда, завернутый в марлю. Причиной того, что не каждый срез, а лишь каждый второй годен для исследования, может быть неправильный угол наклона ножа. Возможно также, что срезы слишком тонки для данного метода или качества заливки. В этом случае нужно на несколько микрометров увеличить толщину среза. Если блок плохо режется, нож подскакивает на поверхности блока и толщина срезов неровная, это объясняется чрезмерным уплотнением материала при фиксации. Исправить этот недостаток нельзя, но можно попробовать подышать на блок и поставить микротомный нож не перпендикулярно, а под углом. Серии срезов при этом получить нельзя, но отдельные срезы режутся лучше. В сухую погоду срезы электризуются и сильно прилипают к ножу. Это можно предотвратить, подышав на нож перед резанием. Маркировка стекол обычно следует за резанием блоков. Для этого при наклеивании срезов на блок один конец стекла оставляют свободным. Надпись на стекло можно наносить с помощью алмазного отметчика, но чаще это делается тушью. Так как тушь размазывается или стирается, следует ее наносить на смазанный белком и высушенный конец стекла. Затем этот конец нагревают над спиртовкой. Надпись при этом фиксируется и в дальнейшем не стирается. Методы исследования Современная гистология располагает большим арсеналом средств для изучения биологических структур на всех уровнях их организации – клеточном, тканевом, органном. Основными объектами исследования являются гистологические препараты или их фотографии, классическим методом – микроскопирование.
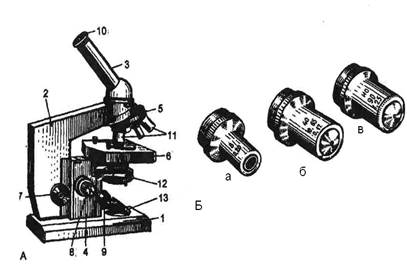
Световая микроскопия наиболее распространенный способ изучения гистологических структур. Современные биологические микроскопы дают максимальное (до 2500 раз) увеличение (произведение увеличения объектива на увеличение окуляра). Люминесцентная микроскопия позволяет наблюдать флуоресценцию (свечение) ряда веществ и структур, возбуждаемую ультрафиолетовыми и сине-фиолетовыми лучами спектра. Флуоресцентная микроскопия является методом прижизненного наблюдения клеток. Она позволяет не только рассмотреть ряд структур в них, но и определить их химический состав. Электронная микроскопия – это метод изучения субмикроскопических структур клетки. В электронном микроскопе роль линз выполняют электромагниты, фокусирующие пучок электронов на препарат. Объект рассматривают на светящемся экране или фотографируют. Разрешающая способность электронного микроскопа примерно в 100 раз больше, чем светового, что дает возможность исследовать клеточные структуры на молекулярном уровне. Цитохимические методы позволяют выяснить химическую природу клеточных структур и характер распределения тех пли иных веществ в клетке. Разработаны методы цитохимического анализа основных соединений, входящих в состав структур клетки (белков, нуклеиновых кислот, углеводов, ферментов). Задание 1. Изучить устройство светового микроскопа, являющегося постоянным рабочим инструментом при изучении курса гистологии и записать в тетрадь основные его части. Научиться пользоваться микроскопом. Микроскоп – оптический прибор, предназначенный для изучения прозрачных объектов, невидимых простым глазом. В световых биологических микроскопах различают две основные части: механическую и оптическую (рис. 5А).
Рис.5. Микроскоп для биологических исследований. Механическая часть: 1 – основание; 2 – тубусодержатель 3 – тубус; 4 – коробка механизма микроподачи; 5 – револьверное устройство; 6 – предметный столик с зажимами-клеммами; 7 – макрометрический винт (кремальера); 8 – микрометрический винт; 9 – винт конденсора. Оптическая часть: 10 – окуляр (с различной степенью увеличения ×5, ×7, ×10, ×15); 11 – объективы (рис. 5.Б): а) малого увеличения (×8) б) большого увеличения (×40) в) иммерсионного увеличения (×90) «Сухие» объективы работают в обычных условиях – без дополнительных маркировок; иммерсионные объективы работают при наличии иммерсии – с дополнительными маркировками в виде полос. Цвет полосы показывает природу иммерсии: чёрная полоса – иммерсия масленая, белая полоса – иммерсия водная.
С оптической частью связано осветительное устройство, которое включает в себя: 12 – конденсор с ирисовой диафрагмой; 13 – зеркало с двумя поверхностями – вогнутой и плоской. Правила пользования микроскопом: 1. Удобно поставить микроскоп на столе. 2. Револьвер замкнуть на засечку, поставив при этом объектив малого увеличения – 8. Фокусное расстояние должно быть при этом около 1 см от объектива. 3. Установить освещение при малом объективе, повернув вогнутое зеркало к источнику света так, чтобы поле зрения было освещено равномерно и достаточно хорошо. 4. Положить препарат на предметный столик, чтобы покровное стекло гистологического препарата было сверху. 5. Рассмотреть препарат при слабом увеличении. Найти нужный участок для последующего детального изучения и поставить его в центр поля зрения микроскопа. Препарат закрепить зажимами и повернуть револьверное устройство на сильный объектив до щелчка. 6. Очень осторожным движением винта кремальеры «на себя» установить фокус сильного увеличения и микровинтом отфокусировать объект (фокусное расстояние около 1-2 мм). 7. Рассмотреть препарат при сильном увеличении, периодически вращая микрометрический винт в обе стороны на четверть оборота для того, чтобы лучше просмотреть глубокие слои изучаемого препарата. 8. Изучить препарат, зарисовать и обозначить. По окончании изучения и зарисовки препарата следует поднять тубус, перевести револьвер на слабое увеличение и только тогда освободить зажимы и снять препарат со столика микроскопа. При малом увеличении конденсор должен быть опущен, а при большом – поднят. Приготовить окулярную указку для микроскопа. Вынуть окуляр и снять его наружные размеры, т. е. изобразить на плотной бумаге (альбомный лист) в виде круга. Внутренние размеры определить по световой линзе. Затем вырезать кольцо. К его поверхности приклеить волос по радиусу центрального поля. После проверки преподавателем правильности изготовления указки поместить ее между линзами окуляра. Для этого отвернуть (против часовой стрелки.) глазную линзу, вставить указку и завернуть линзу обратно. Типы микроскопов
Биомед · ЛОМО · Olympus · Nikon Учебные · Лабораторные · Исследовательские
Таблица 1. Прямые микроскопы
Простые лабораторные бинокулярные микроскопы предназначены для биологических, биохимических, патологоанатомических, цитологических, гематологических, урологических, дерматологических и общеклинических исследований.
Рис.8. Микроскоп СХ 21 (Olympus) – компактный микроскоп с высоким качеством оптики, предназначен для лабораторий общеклинических исследований, идеален для лабораторий с ограниченным рабочим местом, бинокуляр, скорректированная на бесконечность оптика.
Таблица 2. Люминесцентные микроскопы
Рис.9. Микроскоп Биомед 2Л
Люминесцентные микроскопы предназначены для иммунологических исследований с применением флюоресцирующих и ферментных меток, а также гистологических и цитологических исследований в клинической лабораторной диагностике.
Таблица 3. Поляризационные микроскопы
Поляризационные микроскопы предназначены для исследований непрозрачных объектов в отраженном свете, обыкновенном и поляризованном, а также прозрачных объектов в проходящем свете. Области применения: петрография, минералогия, кристаллография, углепетрография, биология, медицина, химия, криминалистика.
Рис.10. Микроскоп Полам Р – 312 (ЛОМО) Таблица 4. Инвертированные микроскопы
Инвертированные микроскопы предназначены для исследования клеточных культур, находящихся в специальной лабораторной посуде. Области применения: иммунология, биотехнология, бактериология, фармакология, биология, сельское хозяйство, экология.
Рис.11. Биолам П2-1 (ЛОМО)
Таблица 5. Стереомикроскопы
Стереомикроскопы предназначены для наблюдения прямого объемного изображения предметов в отраженном или проходящем свете при естественном или искусственном освещении. Микроскопы применяются в криминалистике, биологии, медицине, минералогии, археологии, машиностроении, приборостроении и других областях науки и техники. Микроскопы могут комплектоваться осветителями светлого поля, темного поля, косого света, отраженного света и люминесцентным осветителем.
Рис. 12. Микроскоп Биомед МС-1
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 2912; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.78.107 (0.013 с.) |



 дальнейшей обработки. Парафиновые срезы всегда слегка сморщены и имеют складки. Эти морщинки и складки необходимо расправить, либо поместив срезы на поверхность теплой (не горячей, чтобы не расплавился парафин!) дистиллированной воды, либо в процессе наклеивания на предметное стекло.
дальнейшей обработки. Парафиновые срезы всегда слегка сморщены и имеют складки. Эти морщинки и складки необходимо расправить, либо поместив срезы на поверхность теплой (не горячей, чтобы не расплавился парафин!) дистиллированной воды, либо в процессе наклеивания на предметное стекло.