Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготовление карбол-ксилолаСодержание книги Поиск на нашем сайте
Взять 100 мл ксилола, добавить 22 г карболовой кристаллической кислоты, то есть приготовить раствор с соотношением ксилола и карболовой кислоты 4-5:1. Задачи и правила фиксации Ввиду того, что лишенные питания ткани организма очень быстро начинают претерпевать необратимые изменения (будь то смерть целого организма или искусственное удаление отдельных его частей), первым и обязательным условием микроскопической техники являются предупреждение и задержка посмертных изменений в тканях. Это достигается путем фиксации взятого для исследования материала. Фиксация, как указывает сам термин, представляет собой закрепление, сохранение в обрабатываемом кусочке органа того строения, которое он имел при жизни. В основе действия фиксаторов лежат физико-химические процессы и в первую очередь процесс коагуляции белков. Фиксирующая жидкость должна отвечать двум основным требованиям: 1) достаточно быстро проникать в ткани и 2) действовать «мягко», не вызывая грубых нарушений тканевых структур (сморщивание, чрезмерное уплотнение и т. п.). Необходимо также учитывать то обстоятельство, что ткани и органы химически и морфологически неоднородны, а их структурные элементы в свою очередь существенно отличаются друг от друга, в силу чего фиксирующая жидкость оказывает неодинаковое воздействие на различные компоненты, входящие в состав фиксируемого материала. Из сказанного следует, что не существует такого универсального фиксатора, который бы сохранял одинаково хорошо все составные части клеток и тканей. Одна и та же фиксирующая жидкость может дать совершенно противоположный результат (так, спирт хорошо фиксирует гликоген, но зато полностью растворяет жиры). Большинство фиксаторов оказывает уплотняющее действие на обрабатываемый материал. Все это следует помнить и подбирать фиксатор в зависимости от целей и задач исследования, а также от особенностей фиксируемого материала. Например, для многих гистологических методов хороша формалиновая фиксация. Однако при тонких цитологических и гистохимических исследованиях фиксация в формалине непригодна. Так, при цитологических исследованиях употребляются сложные фиксаторы, в состав которых наряду с формалином входят осмиевая кислота или соли тяжелых металлов (кобальт, уран, кадмий, хром, ртуть и т.д.).
Для того чтобы успешно осуществить процесс фиксации необходимо придерживаться определенных правил: 1. Размер исследуемых кусочков должен быть таким, чтобы произошло полное его пропитывание в оптимальные для данного фиксатора сроки. Решающее значение при этом имеет диффузионная способность фиксирующих жидкостей, которая у разных фиксаторов далеко не одинакова. Например, низкой диффузионной способностью обладают осмий, пикриновая кислота, платина, высокой – формалин, трихлоруксусная и уксусная кислоты, метиловый спирт и др. При фиксации ткани печени 1% осмиевой кислотой в течение 4 часов последняя проникает на глубину лишь 0,5-1 мм, в то время как концентрированный формалин за это же время успевает проникнуть на 4-5 мм. Следовательно, для фиксации осмием надо брать более тонкие кусочки (3-5 мм), чем дл обработки формалином (10-15 мм). В среднем же для большинства фиксаторов берут кусочки толщиной 5-10 мм. 2. 3. Фиксируемый объект нужно помещать так, чтобы обеспечить одновременно его пропитывание со всех сторон. Для этого кусочки кладут на стеклянную или обычную вату, помещенную на дно сосуда, или подвешивают, прошив ниткой (или завернув в марлю). Очень мелкие объекты, которые трудно брать пинцетом и можно повредить при переносе из одного сосуда в другой (тканевые культуры и др.), следует поместить в тонкую стеклянную трубку и, завязав ее нижний конец марлей, пропустить через пробку, закрывающую сосуд с фиксатором (рис. 13). Можно также положить объект на кусочек фильтровальной бумаги и поместить в фиксатор. В обоих случаях объект переносится через все необходимые среды вплоть до самой заливки и не нуждается в вылавливании и захватывании пинцетом. 4. Необходимо строго соблюдать время фиксации, длительность которого определяется свойствами жидкости, исследуемого материала и толщиной взятого кусочка. 5. Фиксацию можно считать законченной после того, как жидкость полностью пропитала фиксируемый объект. Равномерная окраска и одинаковая консистенция тканей на поверхности разреза свидетельствуют о том, что процесс фиксации завершен. Следует помнить, что излишнее пребывание объекта в фиксирующих жидкостях отрицательно сказывается на качестве получаемых препаратов, ибо ткани становятся хрупкими, ухудшается их окрашиваемость, наступает сжатие или набухание и т. д. Лишь некоторые фиксаторы пригодны для длительного хранения материала (10% формалин, жидкость Буэна). В большинстве случаев фиксация производится при комнатной температуре. Однако для некоторых специальных исследований (особенно гистохимических и электронномикроскопических) применяют фиксацию охлажденными жидкостями при температуре +4,0° и ниже. Помимо фиксации кусочков органов и тканей в фиксирующих жидкостях, существует метод прижизненной фиксации органов или целого организма пропусканием (перфузией) фиксатора через кровеносные сосуды. Этот способ особенно ценен для исследований, при которых требуется максимально сократить время между прекращением жизнедеятельности исследуемого объекта и началом фиксации (некоторые гистохимические и гистологические методы), а также зафиксировать целиком крупный орган или весь организм. Для этих целей необходимо взять две бутылки, имеющие выпускные приспособления внизу (емкость сосудов подбирается в зависимости от размеров объекта). На отводные стеклянные трубочки, выступающие из нижних пробок, надевают резиновые трубки, которые натягивают на ответвления тройника. Желательно, чтобы ветви тройника имели
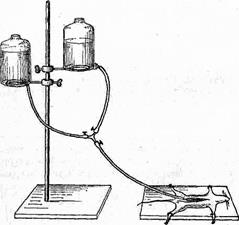
Рис.14. Приспособление для прижизненной фиксации с помощью перфузии фиксирующих жидкостей через кровеносные сосуды.
Закрепив последнюю с помощью одной из нитей, вскрывают вену и, открыв кран, начинают пропускать физиологический раствор (периферический конец артерии перевязывают оставшейся второй ниткой). Как только из вены вместо крови появится светло-розовая жидкость, введение физиологического раствора прекращают и начинают вводить фиксирующую жидкость до тех пор, пока она не начнет вытекать из вены. После этого перевязывают вену и, когда ток жидкости из бутылки прекратится, перевязывают артерию. Затем извлекают орган и кладут в фиксирующую жидкость. Если нужно фиксировать все животное целиком, то наливку производят через аорту или левый желудочек сердца. Важным моментом является переключение системы с физиологическим раствором на фиксирующую жидкость. Раннее переключение приводит к фиксации сосудов, заполненных кровью, что служит препятствием к дальнейшему прохождению фиксатора, позднее вызовет нарушение проницаемости сосудистых стенок и отек тканей.
|
||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 1435; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.92.58 (0.006 с.) |



 Для гистохимических же исследований предпочтительней брать смеси на спиртовой основе. При некоторых исследованиях необходимо пользоваться несколькими фиксирующими жидкостями.
Для гистохимических же исследований предпочтительней брать смеси на спиртовой основе. При некоторых исследованиях необходимо пользоваться несколькими фиксирующими жидкостями.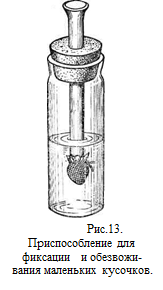 Количество фиксирующей жидкости должно не менее чем в 20 раз превышать объем исследуемого материала, иначе количество е будет недостаточным для осуществления процесса фиксации, а вода, входящая в состав тканей, может изменить свойства фиксатора.
Количество фиксирующей жидкости должно не менее чем в 20 раз превышать объем исследуемого материала, иначе количество е будет недостаточным для осуществления процесса фиксации, а вода, входящая в состав тканей, может изменить свойства фиксатора.


 краны; если же их нет, то нужно приспособить зажимы к трубкам. На оставшуюся свободной (отводящую) ветвь тройника также надевают резиновую трубку, соединенную со стеклянной канюлей (размер канюли подбирают в зависимости от диаметра сосуда). Одну из бутылей наполняют физиологическим раствором, другую фиксирующей жидкостью. Обе бутыли закрепляют в штативе на высоте, достаточной для обеспечения нужного давления жидкости (рис. 14). В случае надобности бутыли можно снабдить манометром и грушей для нагнетания воздуха. Когда система подготовлена, ее заполняют, обращая особое внимание на то, чтобы нигде не было пузырьков воздуха, так как они могут закупорить сосуд и нарушить прохождение фиксатора. Лишь по окончании всей подготовительной работы животному дают наркоз, привязывают к станку и обнажают оперативным путем артерию и вену подлежащего фиксации органа. Артерию берут на две шелковые нити, приподнимают, надрезают стенку маленькими остроконечными кривыми ножницами и вводят канюлю походу кровотока.
краны; если же их нет, то нужно приспособить зажимы к трубкам. На оставшуюся свободной (отводящую) ветвь тройника также надевают резиновую трубку, соединенную со стеклянной канюлей (размер канюли подбирают в зависимости от диаметра сосуда). Одну из бутылей наполняют физиологическим раствором, другую фиксирующей жидкостью. Обе бутыли закрепляют в штативе на высоте, достаточной для обеспечения нужного давления жидкости (рис. 14). В случае надобности бутыли можно снабдить манометром и грушей для нагнетания воздуха. Когда система подготовлена, ее заполняют, обращая особое внимание на то, чтобы нигде не было пузырьков воздуха, так как они могут закупорить сосуд и нарушить прохождение фиксатора. Лишь по окончании всей подготовительной работы животному дают наркоз, привязывают к станку и обнажают оперативным путем артерию и вену подлежащего фиксации органа. Артерию берут на две шелковые нити, приподнимают, надрезают стенку маленькими остроконечными кривыми ножницами и вводят канюлю походу кровотока.