
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сооружений нецентрализованного водоснабженияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Правильное содержание и эксплуатация водозаборных сооружений и устройств имеет решающее значение в профилактике микробного и химического загрязнения питьевой воды. В радиусе ближе 20 м от колодца (каптажа) не допускается мытье автомашин, водопой животных, стирка и полоскание белья, а также осуществление других видов деятельности, способствующих загрязнению воды. Наиболее рациональным способом водозабора из колодцев (каптажей) является подъем воды с помощью насоса, в крайнем случае с помощью общественного ведра (бадьи). Не разрешается подъем воды из колодца (каптажа) ведрами, приносимыми населением, а также вычерпывание воды из общественной бадьи приносимыми из дома ковшами. После каждой чистки или ремонта должна производиться дезинфекция водозаборных сооружений хлорсодержащими реагентами и последующая их промывка. Контроль за качеством воды нецентрализованного Водоснабжения С целью обеспечения постоянства качества воды, безопасности и приемлемости водоснабжения населения контроль должен включать в себя систематическое санитарное обследование не только источника водоснабжения, оборудования и устройств, но и территории, прилегающей к водозаборным сооружениям. Территориальные управления Роспотребнадзора осуществляют плановый или выборочный контроль за качеством воды скважин, колодцев и каптажей общего пользования, а также контроль по разовым заявкам от индивидуальных пользователей. Если при контроле качества воды в скважине, колодце, каптаже отмечено превышение микробиологических и (или) химических показателей по сравнению с нормативами, следует выполнить повторный отбор проб воды и провести дополнительные исследования в объеме микробиологических и (или) химических показателей, по которым отмечено превышение норматива. Стойкое ухудшение качества воды по микробиологическим и (или) химическим показателям в ряде повторно отобранных проб требует установления его причины и устранения. Мероприятия по устранению ухудшения качества воды включают в себя чистку, промывку и при необходимости профилактическую дезинфекцию с последующим составлением акта. Если не удалось выявить или ликвидировать причину ухудшения качества воды или мероприятия по устранению ухудшения качества воды не привели к стойкому улучшению ее качества по микробиологическим показателям, вода в колодце (каптаже) должна постоянно обеззараживаться хлорсодержащими препаратами. При стойком химическом загрязнении воды следует принимать решение о ликвидации водозаборного сооружения или устройства.
ТЕМА: "ГИГИЕНИЧЕСКАЯ ОЦЕНКА ПИТЬЕВОЙ ВОДЫ"
ЗАНЯТИЕ 1. МЕТОДЫ ОПРЕДЕЛЕНИЯ ОРГАНОЛЕПТИЧЕСКИХ СВОЙСТВ И ЖЕСТКОСТИ ВОДЫ, ИХ ГИГИЕНИЧЕСКАЯ ОЦЕНКА.
Учебная цель: I. Ознакомить студентов с санитарно-гигиеническими нормативами на питьевую воду. 2. Ознакомить студентов с принципами гигиенического нормирования и контролем за качеством питьевой воды.
САМОСТОЯТЕЛЬНАЯ РАБОТА СТУДЕНТОВ а) Определение органолептических свойств воды б) Определение жесткости воды.
КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Физиолого-гигиеническое значение воды 2. Эпидемиологическое значение воды 3. Требования к качеству питьевой воды согласно Санитарным правилам и нормам СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества» 4. Гигиенические требования к источникам хозяйственно-питьевого водоснабжения, изложенные в ГОСТе 2761-84 "Источники централизованного хозяйственно-питьевого водоснабжения". 5. Гигиенические требования к источникам децентрализованного водоснабжения согласно Санитарно-эпидемиологическим правилам и нормативам СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников.» 6. Органолептические свойства воды. Методы определения. 7. Жесткость воды, гигиеническое значение. Метод определения.
Жизнедеятельность человека неразрывно связана с различными факторами окружающей среды, одним из которых является вода. Вода является главной составной частью всего органического мира.
ОПРЕДЕЛЕНИЕ ФИЗИЧЕСКИХ И ОРГАНОЛЕПТИЧЕСКИХ СВОЙСТВ ВОДЫ Определение температуры воды. Измерение температуры воды проводится ртутным термометром со шкалой до 100oC и делениями 0,1o непосредственно в пункте выемки воды в водоисточнике или в сосуде емкостью не менее 1 л, куда заливают только что взятую пробу, причем стенки сосуда должны быть ограждены от источников тепла и холода. Отсчет градусов проводят через 5 минут после погружения термометра в воду. Определение вкуса, запаха и цветности воды. Определение интенсивности запаха в исследуемой воде проводят при температуре 20°С. В широкогорлую колбу емкостью 250-300 мл отмеривают 100 мл испытуемой воды, колбу закрывают пробкой, содержимое колбы несколько раз перемешивают и определяют характер и интенсивность запаха. Затем ведут определение запаха при температуре 60°С, для чего колбу с испытуемой водой подогревают на водяной бане до 60°С, горлышко колбы закрывают часовым стеклом. После нагревания содержимое колбы перемешивают, открывают часовое стекло и определяют характер (природу), а также интенсивность запаха, оценивая его по шестибалльной шкале.
СИМВОЛЫ И ТЕРМИНЫ, ХАРАКТЕРИЗУЮЩИЕ ЕСТЕСТВЕННЫЙ ЗАПАХ ВОДЫ
Неестественные запахи от посторонних веществ, поступающих в водоемы, называют по наименованию веществ: ХЛОРНЫЙ, ФЕНОЛЬНЫЙ, БЕНЗИНОВЫЙ и др.
ОЦЕНОЧНЫЕ КРИТЕРИИ ЗАПАХА ВОДЫ
При определении запаха руки и одежда наблюдателя не должны ничем пахнуть (например духами и пр.), воздух помещения должен быть чистым. Определение вкуса и привкуса питьевой воды Различают четыре основных вкуса: СОЛЕНЫЙ, КИСЛЫЙ, ГОРЬКИЙ, СЛАДКИЙ. Все другие ощущения называются привкусами. При исследовании испытуемую воду набирают в рот малыми порциями, не проглатывая, задерживая во рту 3-5 сек. Интенсивность вкуса и привкуса определяют по шестибалльной системе согласно требованиям таблицы.
ИНТЕНСИВНОСТЬ ВКУСА И ПРИВКУСА
Определение вкуса воды, производится только при наличии полной уверенности и безопасности воды (отсутствие ядовитых веществ и загрязнений бактериального происхождения), в противном случае вкус определяется после кипячения и охлаждения воды, что также отмечают в протоколе.
Определение прозрачности Прозрачность зависит от наличия в ней взвешенных веществ. Прозрачность определяю в цилиндрах Генера по шрифту Снеллена. Испытания проводят в стеклянном цилиндре с плоским, хорошо отшлифованным дном. Цилиндр градуирован по высоте на 30 см с делением по 0,5 см и снабжен внизу трубкой (тубус со сливом), на который надевают резиновую трубку с зажимом. Под дном цилиндра на расстоянии 4 см помещен шрифт Снеллена № I. В цилиндр, находящийся на расстоянии не далее 1 метра от окна, после взбалтывания наливают испытуемую воду до края, затем медленно спускают ее через трубку до тех пор, пока станет возможным чтение шрифта. В этот момент определяют и записывают высоту воды в см. Полученную прозрачность испытуемой воды в см по таблице переводят в показатель мутности. Определение цветности воды Цветность воды определяется сравнением воды со стандартными эталонами цветности платиново-кобальтовой или хромово-кобальтовой шкал. Цветность этих шкал от 0 до 50°. При прозрачности ниже 20 см вода перед исследованием фильтруется, при цветности выше 80° - разбавляется дистиллированной водой. Для качественного определения цветности исследуемую воду выливают в такие же цилиндры, которые были использованы для приготовления стандартного эталона, а затем сравнивают окраску воды (испытуемой) сверху с эталоном. Результат цветности выражается в градусах.
Методика определения жесткости воды. Жесткость воды зависит от содержания солей кальция и магния. Иногда она обусловливается также наличием солей закисного железа, марганца, аммония. Различают 3 вида жесткости: · общую; · постоянную; · устранимую (временную). ОБЩАЯ ЖЕСТКОСТЬ - это жесткость сырой воды, обусловленная всеми соединениями кальция и магния (иногда железа и марганца), независимо от того, с какими анионами связаны названные катионы. ПОСТОЯННАЯ ЖЕСТКОСТЬ - жесткость после одночасового кипячения, зависящая от присутствия различных солей, не дающих осадка при кипячении. Главным образом это сульфаты и хлориды кальция и магния. УСТРАНИМАЯ ЖЕСТКОСТЬ - это устранимая при кипячении жесткость, объясняется разрушением бикарбонатов солей кальция, меньше магния, а иногда железа и перевода их в нерастворимые углекислые соли (монокарбонаты), которые оседают на стенках сосудов в виде накипи (CaCO2, MgСО2). Таким образом устранимая жесткость - есть часть общей жесткости, которую можно вычислить по разнице между общей и постоянной жесткостью. Жесткость измеряется в миллиграмм-эквивалентах на литр (мг-экв/л).
ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ Метод основан на способности трилона Б образовывать прочные комплексы с ионами кальция и магния. Определение проводят титрованием пробы воды трилоном Б при рН 10 в присутствии индикатора. По количеству трилона Б, пошедшего на титрование взятого объема воды, определяют общую жесткость. В качестве индикатора применяют эрихром черный (хромоген черный специальный) или хромоген темно-синий кислотный. В щелочной среде в присутствии ионов кальция и магния первый индикатор (хромоген черный специальный) дает виннокрасное окрашивание второй - розовокрасное. В отсутствии их - соответственно синее с зеленоватым оттенком и синее с сиреневым оттенком.
ХОД ОПРЕДЕЛЕНИЯ 100 мл исследуемой воды наливают в коническую колбу, добавляют 5 мл аммиачно-буферного раствора и 5-7 капель индикатора. Титруют медленно при интенсивном помешивании 0,05 н раствором трилона Б до переходной окраски из виннокрасного в синий с зеленоватым оттенком. Жесткость рассчитывают в мг-экв по формуле:
а - кол-во р-ра трилона Б в мл; K - поправочный коэффициент к титру р-ра трилона Б; Y - объем пробы воды, взятый для титрования, в мл; 1000 - пересчет мл в литры.
ПРИМЕЧАНИЕ: Если на титрование расходуется больше 10 мл р-ра трилона Б, необходимо взять меньший объем исследуемой воды и довести его дистиллированной водой до 100 мл. В расчет берется количество взятой пробы воды.
ЗАНЯТИЕ 2. МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОКАЗАТЕЛЕЙ ОРГАНИЧЕСКОГО ЗАГРЯЗНЕНИЯ ВОДЫ И ИХ ГИГИЕНИЧЕСКАЯ ОЦЕНКА.
ЦЕЛЬ ЗАНЯТИЯ: 1. Изучить особенности антропогенного загрязнения воды 2. Освоить методы определения показателей органического загрязнения воды.
ОБЪЕМ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Определение содержания аммонийных солей (аммиака) в воде. 2. Определение содержания солей азотистой кислоты (нитритов) в воде. 3. Определение содержания солей азотной кислоты (нитратов) в воде. 4. Определение окисляемости исследуемой пробы воды. 5. Написание общего протокола по исследованной пробе воды и ее гигиеническая оценка по исследованным показателям.
КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Эпидемиологическое значение воды. 2. Источники органического загрязнения воды. 3. Поведение органических веществ в воде. 4. Санитарно-гигиеническое значение показателей триады азота в воде и допустимые их количества в питьевой воде. 5. Принцип метода определения триады азота в воде. 6. Принцип метода определения окисляемости воды.
Азотсодержащие вещества являются важным показателем органического загрязнения воды, т.к. они образуются при разложении белковых веществ, попадающих в источники с хозяйственно-фекальными и промышленными отбросами. Аммиак - продукт белкового распада, поэтому его обнаружение свидетельствует о свежем загрязнении. Нитриты указывают на некоторую давность загрязнения (время, необходимее для превращения аммиака в нитриты). Нитраты свидетельствуют о более давних сроках загрязнения. По азотсодержащим веществам можно судить о характере загрязнений водоисточников. Если в воде обнаружен аммиак, а при повторных анализах он отсутствует, то можно говорить о случайном загрязнении. Наличие в воде аммиака и нитритов свидетельствует о том, что вода ранее не загрязнялась, но сравнительно недавно появился постоянно действующий источник загрязнения. Обнаружение аммиака, нитритов и нитратов свидетельствует о явном неблагополучии водоисточника, подвергающегося постоянному загрязнению. Если в воде обнаруживаются нитраты, но нет аммиака, это указывает на то, что ранее существовал постоянно действующий источник загрязнения, а в настоящее время загрязнение источника не происходит. Наличие в воде аммиака и нитратов при отсутствии промежуточного продукта - нитритов, говорит о том, что водоисточник загрязняется периодически. Обнаружение нитратов говорит об окончании процессов минерализации. Азотсодержащие вещества могут быть и минерального происхождения. Это следует особо учитывать при исследовании артезианских вод, В таких случаях необходимо обращать внимание на наличие других показателей загрязнения, особенно на бактериологические показатели и величины окисляемости. Последняя будет высокой без нагревания воды, что также свидетельствует о минеральном происхождении данного показателя. Однако высокая окисляемость при кипячении воды говорит о наличии в ней органических загрязнений.
Определение азота аммиака (аммонийных солей) (качественное с приближенной количественной оценкой) Азот аммонийных солей в питьевой воде качественно и количественно определяют с помощью реактива Несслера, который дает желтое окрашивание в присутствии солевого аммиака. В пробирку налить 1/3 исследуемой воды, прибавить 2-3 капли раствора сегнетовой соли для удержания солей Ca и Mg и 5 капель реактива Несслера. Через 10 мин определяют содержание аммонийного азота по таблице 1
Определение азота нитритов Принцип метода основан на образовании ярко окрашенных азокрасок при взаимодействии нитритов в кислой среде с реактивом Грисса. Наливают 1/2 пробирки испытуемой воды, прибавляет 10 капель реактива Грисса и нагревают на водяной бане 5 мин. Приближенное содержание определяют по таблице 2.
Определение азота нитратов Принцип метода основан на переводе салициловой кислоты растворенного в воде азота нитратов в нитропроизводные фенола, образующие со щелочью соединения, окрашенные в желтый цвет. Качественная реакция: в пробирку налить 1/3 исследуемой воды, прибавить 2 капли 8% раствора поваренной соли, добавить 4-5 кристаллов дифениламина, взболтать. По стенке пробирки осторожно прилить 10 капель концентрированной серной кислоты. Наличие азота нитратов в воде дает образование синего кольца. Таблица 1 Приближенное содержание аммонийного азота
Таблица 2 Приближенное содержание азота нитритов
Определение окисляемости воды. Под окисляемостью воды понимается потребность в кислороде, необходимая для окисления продуктов распада органических веществ растительного и животного происхождения, содержащихся в воде. Окисляемость выражается количеством мг кислорода, расходуемого на окисление веществ в 1 литре воды Высокая окисляемость воды обусловлена наличием в ней продуктов распада органических веществ растительного и животного происхождения. В чистых питьевых водах окисляемость не превышает 2-4 мг кислорода на 1 л воды. В болотных водах при отсутствии азотсодержащих веществ допускается окисляемость до 5-6 мг/л, т.к. в подобной воде органические вещества содержат гумус (растительное коллоидное вещество), являющейся питательной средой для микроорганизмов. Определение окисляемости воды проводится титрованным раствором марганцовокислого калия в кислой среде. Принцип этого метода основан на способности марганцовокислого калия в кислой среде в присутствии органических веществ выделять атомарный кислород, идущий на их окисление. Раствор марганцовокислого калия при этом обесцвечивается вследствие превращения KMnO4 в MnSO4. По количеству разложившегося KMnO4 вычисляют окисляемость. Реактивы: 0,01 н раствор KMnO4, 1 мл которого выделяет 0,08 мг кислорода; 0,01 н раствор щавелевой кислоты (1 мл которого идет на окисление 0,08 мг кислорода); 25% р-р серной кислоты. Техника исследования окисляемости воды. 1. 100 мл исследуемой воды наливают в колбу емкостью 250 мл, добавляют 5 мл 25% серной кислоты, 10 мл KMnO4 и нагревают жидкость до кипения. 2. Жидкость кипятят 10 мин. с начала закипания. 3. Колбу снимают с нагревательного прибора, наливают в нее 10 мл 0,01 н раствора щавелевой кислоты для разрушения не вошедшего в реакцию с органическими веществами воды KMnO4 и перемешивают содержимое колбы путем кругообразного взбалтывания до обесцвечивания. 4. Обесцвеченный горячий раствор титруют 0,01 раствором KMnO4 до слаборозового окрашивания. По количеству израсходованного KMnO4 производят расчет окисляемости. 5. Перед проведением расчета окисляемости определяют количество KMnO4, идущего на 10 мл щавелевой кислоты и поправочный коэффициент KMnO4. Для этого в колбу, содержащую еще горячую, оттитрованную до слаборозового цвета жидкость, прибавляют 10 мл 0,01 н раствора щавелевой кислоты и тотчас же титруют 0,01 н раствором KMnO4 до такой же розовой окраски. Поправочный коэффициент рассчитывают по формуле:
К - поправочный коэффициент Y - количество мл 0,01 н раствора KMnO4 , израсходованного на титрование 10 мл щавелевой кислоты. 6. Расчет окисляемости в миллиграммах на 1 л воды проводится по формуле:
Y1 - общее кол-во мл 0,01 н р-ра KMnO4 , пошедшего на окисление 100 мл воды и на 10 мл. щавелевой кислоты. Y2 - кол-во мл 0,01 н р-ра KMnO4 , идущего на окисление 10 мл щавелевой кислоты. К - поправочный коэффициент р-ра KMnO4. 0,08 - кол-во мг кислорода, образуемое 1 мл 0,01 н р-ра KMnO4 Q - объем исследуемой воды в мл. Пример: к 100 мл исследуемой воды прибавлено 10 мл 0,01 н р-ра KMnO4. После кипячения и добавления 10 мл 0,01 н р-ра щавелевой кислоты пошло на титрование 5 мл р-ра KMnO4. При установке поправочного коэффициента (К) на 10 мл щавелевой к-ты израсходовано 9,5 мл р-ра KMnO4
Тогда окисляемость исследуемой воды будет:
ПРОТОКОЛ исследования воды 1. Наименование водоисточника ______________________________________
2. Дата, время взятия пробы ________________номер пробы ______________
3. Дата поступления пробы ___________________________________________
4. Вид посуды, сохранность упаковки и доставленной на исследование пробы воды ______________________________________________________________
5. Начало производства анализа _______________________________________
6. Результаты санитарно-гигиенического анализа пробы воды.
7. Заключение по качеству воды ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
8. Рекомендации по улучшению качества воды ____________________________________________________________________________________________________________________________________________________________________________________________________________
Подпись проводившего исследование ___________________________________
РАЗДЕЛ V ОСНОВЫ ГИГИЕНЫ ПИТАНИЯ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 712; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.014 с.) |

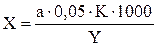 , где:
, где: , где:
, где: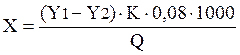 , где:
, где: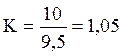
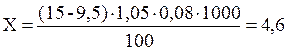 мг О2 на 1 л
мг О2 на 1 л


