Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Преждевременная стимуляция предсердийСодержание книги
Поиск на нашем сайте
Анализ реакций синусового узла на преждевременную деполяризацию предсердий позволяет определить ряд важных электрофизиологических характеристик нормальной и аномальной функции синусового узла и синоатриального проведения [172—175]. Стимуляция предсердий осуществляется теми же методами, которые используются при оценке времени восстановления функции синусового узла: преждевременный стимул наносят в позднюю фазу диастолы при спонтанном синусовом ритме после каждого восьмого возбуждения с постепенно уменьшающимися интервалами сцепления (шаг 10 мс). Таким способом период синусового ритма сканируется до тех пор, пока предсердие не перестает отвечать на стимул. Идентифицировано 4 типа реакций синусового узла на преждевременное возбуждение предсердий (ПВП) в зависимости от временного расположения ПВП в синусовом цикле (А1—А1) и от того, происходит ли ретроградное проникновение ПВП в синусовый узел: 1) компенсация вследствие экстрастимуляции в позднюю фазу диастолы, при которой вызванное возбуждение не может проникнуть в синусовый узел из-за столкновения в околоузловой зоне с волной нормальной синусовой деполяризации; 2) перезапуск, вызываемый преждевременной деполяризацией синусового узла экстрастимулом, в результате чего интервал А2—А3 имеет меньшую величину, чем компенсаторная пауза; 3) интерполяция, когда экстравозбуждение не проникает в синусовый узел, но и не препятствует проведению следующего импульса в предсердия; 4) циркуляция возбуждения, обусловленная отражением волны преждевременного возбуждения, в результате чего возникает ранняя «синусовая» деполяризация (рис. 6.15). Идентификация тканей околоузловой области в предсердии кролика, осуществленная Strauss и Bigger [176], в значительной мере способствовала лучшему пониманию перечисленных выше явлений. Околоузловые клетки по своим характеристикам существенно отличаются как от миокарда предсердий, так и от клеток синусового узла и могут являться потенциальным барьером для проведения возбуждения. Волокна синоатриального узла и околоузловой ткани по некоторым электрофизиологическим характеристикам близки тканям АВ-узла. В частности, скорость деполяризации потенциала действия ПВП постепенно снижается по мере более раннего нанесения экстрастимула в фазу диастолы, т. е. здесь возможно декрементное проведение [177]. Более того, ПВП может быть полностью блокировано в ретроградном направлении в пределах околоузловой зоны или внутри синоатриального узла, если к моменту его прихода эти ткани находятся в состоянии абсолютной рефрактерности [153, 173—175]. Явление компенсаторной паузы, наблюдаемое при возникновении ПВП в позднюю фазу синусового цикла, может быть связано с электрофизиологическими особенностями околоузловой зоны, так как ПВП не проникает в синусовый узел или не влияет на его активность и последующее синусовое возбуждение возникает вовремя. Если околоузловая ткань аномальна (что возможно у больных с синдромом слабости синусового узла), зона компенсации может занимать большую часть синусового цикла, чем в случае интактной околоузловой ткани. Таким образом, даже более ранние ПВП будут сталкиваться с уже существующим синусовым возбуждением в околоузловой области. Эти события составляют электрофизиологическую основу синоатриального блока первой степени — одного из проявлений синдрома слабости синусового узла (рис. 6.16) [178, 179].
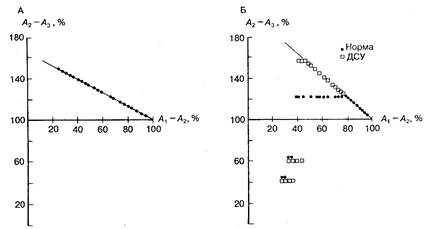
Рис. 6.15. Различные типы реакций синусового узла на преждевременную стимуляцию. А — схематически представлены различные типы реакций синусового узла на экстрастимул (а—г): компенсация, перезапуск, интерполяция и циркуляция. Компенсация предполагает, что преждевременное возбуждение предсердий не деполяризует синусовый узел, в результате чего возникает компенсаторная пауза. Преждевременное возбуждение предсердий, возникающее на более ранней фазе синусового цикла, приводит к преждевременной деполяризации синусового узла с последующим перезапуском (т. е. «а» меньше компенсаторной паузы). Очень редко преждевременное возбуждение предсердий может быть действительно интерполировано, в этом случае оно совсем не влияет на регистрируемую длительность синусового цикла. Еще реже преждевременная деполяризация предсердий, возникающая в ранней фазе, обусловливает задержку проведения в области синусового узла, за которой следует циркуляция импульсов в синусовом узле. Б — графическое представление тех же реакций; по горизонтальной оси — интервал сцепления тест-стимула (интервал А1—А2), выраженный в процентах от длительности основного синусового цикла А1 —А1; по вертикальной оси — продолжительность возвратного цикла (интервал А2—A3, также выраженный в процентах от длительности основного синусового цикла). Точками а, б, в и г обозначены типы реакций, которые показаны на фрагменте А (компенсация, перезапуск, интерполяция и циркуляция). Наклонная прямая соответствует линии компенсации. S — стимул.
На некотором протяжении зоны перезапуска синусового узла, примерно в середине предсердного цикла, постэкстрасистолическая пауза (А2— А3) постепенно увеличивается по мере уменьшения интервала сцепления экстрастимула с синусовым возбуждением. Было предложено три механизма такого увеличения: 1) постепенное снижение скорости проведения преждевременного импульса; 2) временное угнетение активности пейсмекерных клеток синусового узла [172, 174, 175, 180]; 3) смещение водителя ритма в пределах области синусового узла [15]. У больных с аномалиями синоатриального проведения зона перезапуска теоретически занимает меньшую часть синусового цикла, чем у здоровых людей [161]. Ранние ПВП, достигающие околоузловой ткани, когда она еще находится в эффективном рефрактерном периоде после предшествующего синусового импульса, блокируются у входа в синусовый узел и, следовательно, не в состоянии перезапустить его. Следующий спонтанный импульс, возникающий в начале цикла, проходит через околоузловую ткань, восстановившую свою возбудимость, и проникает в предсердие, в результате чего наблюдается интерполяция ПВП. Зона интерполяции была детально изучена в микроэлектродной лаборатории [181]. Все более ранние преждевременные возбуждения блокируются здесь на все большем расстоянии от узла. Следовательно, синоатриальное соединение обеспечивает скорее прогрессивную градацию рефрактерности, нежели дискретное блокирование. Более того, ПВП, возникающие позднее в зоне интерполяции, могут здесь проникнуть в синусовый узел. Однако их амплитуда слишком мала, и они не в состоянии перезапустить узел. Скорее всего, такие ранние ПВП уменьшают максимальный диастолический потенциал, вызывают фазовую задержку достижения максимального диастолического потенциала и изменяют терминальную часть фазы 3 и (или) начало фазы 4 трансмембранного потенциала действия, задерживая появление восстановленного спонтанного возбуждения и вызывая неполную интерполяцию.
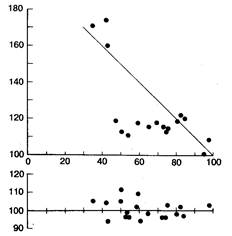
Рис. 6.16. Графики отношения А1—A2/A2—A3, которое может ожидаться у здоровых лиц (темные кружки на Б) и у больных с дисфункцией синусового узла (темные кружки на А и светлые квадраты на Б). А — все точки располагаются на прямой линии, указывая на то, что преждевременное возбуждение предсердий даже в ранней фазе неспособно проникнуть в синусовый узел и перезапустить его; это является примером синоатриальной блокады I степени. Б — у больных с дисфункцией синусового узла (ДСУ) можно ожидать более продолжительной компенсации, уменьшения зоны перезапуска и увеличения зон интерполяции и циркуляции.
Очень ранние ПВП могут достичь той части околоузловой области и синусового узла, которая достаточно восстановилась после предыдущего спонтанного синусового возбуждения, и, следовательно, беспрепятственно проникнуть в эти ткани. Однако ретроградное проведение будет существенно замедлено, что позволяет другим участкам синусового узла и околоузловой области восстановить свою возбудимость. Такие электрофизиологические условия способствуют возникновению синусовой циркуляции возбуждения. Теоретически, аномалии синоатриальной области повышают вероятность циркуляции в синусовом узле, а также появления предсердной аритмии [94, 95, 182, 183]. Такие явления позволяют дать электрофизиологическое обоснование повышенной частоты развития наджелудочковой тахиаритмии, наблюдаемой у больных с синдромом слабости синусового узла. Таким образом, у больных со слабым синусом и аномалиями синоатриального соединения можно ожидать следующие реакции на преждевременную стимуляцию предсердий: 1) увеличение зоны компенсации; 2) уменьшение зоны перезапуска синусового узла; 3) увеличение зоны интерполяции; 4) увеличение зоны синусовой циркуляции возбуждения (см. рис. 6.16).
Рис. 6.17. Отношение тест-интервала А1—S2 к ответному интервалу S2—А3. График внизу показывает отношение следующего интервала А3—А4 к контрольному а1—a1. Обратите внимание: на верхнем графике за зонами компенсации и перезапуска следует вторая зона компенсации, возникающая при очень ранних преждевременных возбуждениях предсердия.
Недавно был описан пятый тип реакции синусового узла на преждевременную деполяризацию предсердий — вторая компенсаторная пауза после очень ранних ПВП (рис. 6.17) [184]. Столкновение ранних ПВП с последующим синусовым возбуждением не может быть просто следствием случайного совпадения во времени, как в случае поздних ПВП. Значительная преждевременность ранних ПВП обеспечивает достаточно времени для осуществления ретроградного синоатриального проведения до момента появления следующего синусового возбуждения. Поэтому проведение таких ПВП по ткани синоатриального соединения должно быть существенно замедлено. Короче говоря, ранние ПВП, за которыми следует синусовая компенсаторная пауза, попадают в синоатриальное соединение во время относительного рефрактерного периода, когда декрементное проведение начинает проявляться электрокардиографически в виде компенсации. В 1962 г. Langendorf и соавт. [185], анализируя поверхностные электрокардиограммы больных с предсердной парасистолией, определили некоторые функциональные характеристики проведения между синоатриальным узлом и предсердием. На основе этих клинических наблюдений, а также экспериментальных данных, полученных Bonke и соавт. [173], Strauss и соавт. [175] описали метод определения времени синоатриального проведения с помощью программной стимуляции предсердий. При расчете ВСАП предполагается, что разность усредненной длительности цикла возврата (А2—А3) в зоне перезапуска синусового узла и длительности спонтанного цикла (A1— А1) равна времени, необходимому для ретроградного проведения ПВП по околоузловой ткани, плюс время, требуемое перезапущенному синусовому возбуждению для антероградного прохождения по околоузловой ткани и проникновения в предсердие (рис. 6.18). Аномально увеличенное ВСАП соответствует синоатриальному блоку первой степени, характерному для некоторых больных с синдромом слабости синусового узла [134, 176, 186—189].
Рис. 6.18. Определение времени синоатриального проведения (ВСАП). Схематически представленная ЭКГ показывает события, происходящие до и после преждевременного возбуждения предсердий. На лестничной диаграмме звездочкой отмечена преждевременная деполяризация предсердий, которая преждевременно возбуждает синусовый узел (стрелка вверх); двойные кружки показывают, где в норме должна была бы происходить данная деполяризация синусового узла; последний темный кружок указывает момент «разрядки» синусового узла после перезапуска. ВСАП определяется по приведенной внизу формуле путем вычитания основного интервала а1—А1 (1000 мс) из величины интервала S2—А3, наблюдаемого времени восстановления (1150 мс). Общее ВСАП, включающее время антероградного и ретроградного проведения, составляет 150 мс, а время проведения в одном направлении — 75 мс.
Однако использование этого метода требует определенных допущений: 1) все ПВП, вызывающие постэкстрасистолическую паузу, длительность которой меньше компенсаторной, должны перезапускать синусовый узел; 2) ПВП не должны угнетать автоматизм синусового узла, в противном случае будет получено завышенное значение ВСАП; 3) влияние ПВП на антероградное и ретроградное проведение должно быть одинаковым; 4) ВСАП должно быть нечувствительным к изменениям спонтанного синусового ритма, типичным для больных с нарушениями функции синусового узла; 5) скорость ретроградного синоатриального проведения не должна зависеть от места стимуляции предсердий. На изолированных миокардиальных тканях Miller и Strauss [190] показали, что при переходе от компенсаторной паузы к более короткой постэкстрасистолической паузе имеют место ПВП, неспособные проникнуть в синусовый узел и перезапустить его. Сокращение цикла возврата синусового узла в таких случаях обусловлено уменьшением потенциала действия синусового узла вследствие электротонического взаимодействия клеток синусового узла и окружающих клеток во время реполяризации. Такое артефактное уменьшение цикла возврата приводит к заниженной оценке реального времени синоатриального проведения. Более того, ПВП, вызываемые в середине синусового цикла в сердце животных, способны угнетать автоматизм синусового узла и приводить к смещению водителя ритма [172]. Однако мнения относительно степени влияния угнетенного пейсмекерного автоматизма на оценку ВСАП у человека весьма разноречивы [191]. Miller и Strauss [190] отмечают, что определяемые величины времени антероградного и ретроградного проведения неравнозначны; ретроградное проведение обычно быстрее антероградного. Кроме того, ВСАП, по-видимому, варьирует в зависимости от длительности спонтанного синусового цикла [192, 193]; при более низкой частоте сердечного ритма определяются меньшие значения ВСАП, чем при более высокой частоте. Наконец, Yamaguchi и Mandel [156] недавно показали, что скорость ретроградного проведения ПВП не зависит от места стимуляции предсердия (табл. 6.1). Это может быть связано с существованием специализированных функциональных путей проведения между синусовым узлом и предсердием [194]. Несмотря на все эти проблемы, метод Strauss и соавт. [175] служит полезным дополнением других диагностических способов оценки дисфункции синусового узла. В настоящее время в принципе возможна дифференциация аномалий генераторной функции синусового узла и нарушений проведения импульсов. Нормальные границы рассчитанного времени синоатриального проведения у больных без явного нарушения функции синусового узла, по данным разных авторов, составляют 56 ±22 мс [162], 70 ±30 мс [161], 84,5±26 мс [180], 92 ±60 мс [195], 82 ± 19,2 мс [191], 88 ±7 мс [149]. Однако у таких больных часто имеются признаки органического заболевания сердца: у некоторых из них — аномалии дистальной части проводящей системы, у многих — ишемическая болезнь сердца, у других — патология клапанной системы. Как сообщают Jordan и соавт. [160], у больных с атеросклеротическим поражением артерии синусового узла, но без клинических или электрокардиографических проявлений дисфункции синусового узла регистрируются значительно более высокие (хотя и «нормальные») значения ВСАП, чем у больных с поражением коронарных сосудов без вовлечения артерии синусового узла. Аналогичные различия в величинах ВСАП иногда обнаруживаются у больных с бессимптомной дисфункцией синусового узла, связанной с другой предшествующей патологией. Следует отметить, что прогрессирование поражения синоатриальной области до возникновения явных клинических и электрокардиографических симптомов может быть динамическим процессом, который, однако, развивается постепенно.
Таблица 6.1. Время синоатриального проведения и точки перехода при стимуляции пограничного гребня, коронарного синуса и межпредсердной перегородки
Обозначения: SEM—среднее стандартное отклонение (даны средние значения ±SEM); N==18; ^ —достоверное отличие от данных стимуляции пограничного гребня; Д — достоверное отличие от времени ретроградного проведения; л и ^ р<0,05; ДЛ и + р<0,01; ДЛД и ft p<0,005.
Более того, точно так же, как различия в вегетативном тонусе могут влиять на время восстановления функции синусового узла, изменения активности вегетативной нервной системы могут отражаться на величине ВСАП. Bonke и соавт. [172], а также Klein и соавт. [174] удалось продемонстрировать отсутствие влияния атропина на синоатриальное приведение. Miller и Strauss [190] отметили, что атропин или пропранолол не оказывает влияния на уменьшение потенциала действия синусового узла при ПВП. Однако Dhingra и соавт. [196] обнаружили у 17 здоровых добровольцев значительное уменьшение рассчитанного ВСАП после введения 1—2 мг атропина (от 103 ±5,7 мс до 58 ±3,9 мс), а также сокращение зоны компенсации. Уменьшение ВСАП у человека при введении атропина происходит независимо от каких-либо изменений частоты сердечного ритма, о чем свидетельствуют наблюдения, согласно которым продолжительность цикла возврата после ПВП сокращается в большей степени, чем длительность синусового цикла [196]. В соответствии с гипотезой об улучшении проведения по околоузловой ткани с помощью атропина было показано, что этот препарат устраняет интерполяцию и синусовое отражение у некоторых пациентов [196]. Применение методов увеличения рефрактерного периода околоузловой ткани, таких как стимуляция предсердий, с частотой, превышающей частоту синусового ритма, повышает вероятность возникновения интерполяции и циркуляции у здоровых добровольцев [195]. Влияние атропина на ВСАП у больных с дисфункцией синусового узла весьма вариабельно. У некоторых больных со слабым синусом введение атропина значительно уменьшает ВСАП, тогда как у других отмечается лишь минимальное его уменьшение [196, 197]. Dhingra и соавт. [198] отметили, что средние значения ВСАП до и после введения атропина у 21 больного с синдромом слабости синусового узла достоверно не отличаются от опубликованных ранее средних величин ВСАП на фоне атропина у 17 больных без признаков дисфункции синусового узла [196]. Отдельные больные с синдромом слабости синусового узла, у которых при введении атропина наблюдается значительное увеличение ВСАП, могут иметь более низкий базальный уровень парасимпатической активности и, следовательно, более низкий остаточный парасимпатический тонус после назначения аналогичных доз атропина. Иначе говоря, симпатическая активность в покое у них выше, чем у больных, не обнаруживающих уменьшения ВСАП. Наконец, у этих больных могут отсутствовать аномалии собственных электрофизиологических характеристик синоатриального проведения, и дисфункции синусового узла у них — это прежде всего проявление нарушений вегетативного контроля синоатриального проведения. Dhingra и соавт. [198] при введении атропина больным с синдромом слабости синусового узла не находят среднего уменьшения зоны компенсации или увеличения зоны перезапуска синуса. Аналогично, атропин не оказывает влияния на интерполяцию и реакцию эхо у таких больных. Strauss и соавт. [199] отмечают, что пропранолол (1 мг/кг) значительно увеличивает ВСАП у больных со слабым синусом. Однако этот результат можно частично объяснить влиянием пропранолола на автоматизм синусового узла. В отсутствие лекарственной терапии у больных с синдромом слабости синусового узла и аномальной собственной частотой сердечного ритма отмечаются более высокие значения ВСАП, чем у больных со слабым синусом и нормальной собственной частотой ритма сердца. Кроме того, на фоне вегетативной блокады у больных с синдромом слабости синусового узла и нормальной собственной частотой сердечных сокращений наблюдается значительно большее увеличение ВСАП, чем у больных с аномальной собственной частотой сердечного ритма. Однако, основываясь лишь на определении собственной частоты сердечного ритма, невозможно точно идентифицировать больных с нормальным ВСАП и больных с аномальным ВСАП либо в контроле, либо на фоне полной медикаментозной вегетативной блокады. Например, у многих больных с синдромом слабости синусового узла и нормальной СЧСР наблюдается аномальное ВСАП, а больные с тем же синдромом и аномальной СЧСР часто имеют нормальное ВСАП. Таким образом, вегетативная блокада, по-видимому, более целесообразна при выявлении собственной пейсмекерной дисфункции синусового узла, чем при диагностике аномалий синоатриального проведения. Однако подобное утверждение может оказаться слишком поспешным. Оценка синоатриального проведения на основании определения автоматической активности синусового узла (т. е. СЧСР) может быть неадекватной. Для констатации наличия собственных аномалий синоатриального проведения необходимо сравнение значений известного или прогнозируемого нормального собственного ВСАП и аномальной СЧСР. Таким образом, определение нормальных границ собственного ВСАП потребует тех же немалых усилий, какие пришлось приложить Jose для установления норм СЧСР в различных возрастных группах. В настоящее время нормальные значения собственного ВСАП не установлены. По данным Dhingra и соавт. [188], частота аномально увеличенного расчетного ВСАП у 418 больных без признаков дисфункции синусового узла составляет 2 %. Однако эти авторы в качестве критерия оценки аномального ВСАП использовали величину в 152 мс, т. е. значительно большую, чем у других исследователей. Следовательно, их число «ложноположительных» результатов может быть заведомо заниженным. Столь высокое предельное значение, полученное для здоровых людей, позволяет также объяснить низкую частоту аномального ВСАП у больных с подозрением на дисфункцию синусового узла (29% из 52 больных). По данным Breithardt и соавт. [189], у 45 % из 42 больных с различными проявлениями дисфункции синусового узла было зарегистрировано увеличенное ВСАП; в качестве верхней границы нормы использовалась величина в 120 мс. Используя 215 мс в качестве нормальной величины суммарного времени антероградного и ретроградного проведения, Strauss и соавт. [134] у 38 % из 16 больных с нарушением функции синусового узла обнаружили аномальное увеличение суммарного ВСАП. Недавно Breithardt и соавт. [189] попытались выявить корреляцию между увеличением ВСАП и ВВСУ и специфическими электрокардиографическими аномалиями у больных с синдромом слабости синусового узла. У больных с асимптоматической синусовой брадикардией значения ВВСУк или ВСАП не были достоверно больше, чем в контрольной группе, тогда как у больных с симптомами были получены большие величины. У больных с синдромом брадикардии—тахикардии и (или) эпизодическим синоатриальным блоком отмечены существенно более высокие значения ВВСУ, чем в контрольной группе, хотя величины ВСАП у них не отличались от контроля. Видимо, ВВСУ является до некоторой степени более чувствительным показателем, чем ВСАП: его определение дает меньше ложноотрицательных результатов у больных с дисфункцией синусового узла (рис. 6.19). Тем не менее определение ВСАП при идентификации больных с синдромом слабости синусового узла и здоровых лиц оказалось более целесообразным, чем считалось ранее [133].
Метод непрерывной стимуляции для определения времени синоатриального проведения
Таким образом, мы рассмотрели ограничения в применении метода преждевременной стимуляции предсердий для определения времени синоатриального "проведения. Для того чтобы избежать угнетения синусового узла, смещения водителя ритма и других возможных явлений, Narula предложил новый метод определения времени синоатриального проведения, использующий усиленную стимуляцию предсердий [200]. Предсердия стимулируются серией из 8 стимулов с частотой на 10 уд/мин выше основного синусового ритма. Интервал (в миллисекундах) между последним вызванным возбуждением и первым возвратным синусовым возбуждением на предсердной электрограмме определяется как суммарное время ретроградного и антероградного синоатриального проведения (рис. 6.20). С клинической точки зрения, при такой частоте стимуляции водитель ритма синусового узла, видимо, не угнетается и при анализе циклов, следующих за возвратным (А3—A4, А4—A5), не возникает подозрений на смещение пейсмекера. Получаемые данные воспроизводимы. Преимущество метода состоит в том, что он не требует сложного оборудования (программный стимулятор) и трудоемких расчетов для определения времени синоатриального проведения, необходимых при использовании метода преждевременной стимуляции предсердий.
Рис. 6.19. Отношение корригированного времени восстановления функции синусового узла (КВВСУ — по горизонтальной оси) и времени синоатриального проведения (ВСАП — по вертикальной оси). На правом графике представлены данные контрольной группы больных без клинических признаков дисфункции синусового узла. Обратите внимание, что КВВСУ и ВСАП у всех больных находятся в нормальных пределах. На левом графике — данные больных с синусовой брадикардией, но без серьезных жалоб (треугольники) и с синусовой брадикардией с жалобами на дисфункцию сердечно-сосудистой системы (ромбы), а также данные больных с синдромом брадикардии — тахикардии и синоатриальным блоком (кружки). Наиболее аномальные величины КВВСУ и ВСАП отмечаются при синдроме брадикардии — тахикардии с синоатриальным блоком. У большинства больных с синусовой брадикардией, но без симптоматики ЦНС указанные параметры лежат в нормальных пределах 17 89].
Рис. 6.20. Определение времени синоатриального проведения (ВСАП) по новому методу, предложенному Narula. А—Д—кривые, полученные в контроле и после усиленной стимуляции при длительности цикла (ДЦ) 650 и 550 мс. Обратите внимание: периоды времени синоатриального проведения, определявшиеся после последнего вызванного возбуждения до начала следующего спонтанного синусового комплекса, практически одинаковы. ПП — правое предсердие; ПГ — пучок Гиса; П — предсердие; Отв. I — отведение I; Пр — преждевременный (предсердный комплекс); ПВ — преждевременное возбуждение [200].
Величины времени синоатриального проведения, полученные при непрерывной стимуляции предсердий, верифицировались в микроэлектродной лаборатории [201]. При использовании этого метода нередко возникают те же проблемы, с которыми приходится сталкиваться при применении метода преждевременной стимуляции предсердий. Получению ошибочных результатов при обоих методах способствуют уменьшение потенциала действия синусового узла, угнетение автоматизма и смещение основного водителя ритма. Оценка ВСАП при непрерывной стимуляции предсердий осложняется еще и недостаточным захватом синусового узла, особенно при низкой частоте стимуляции (<5 уд/мин чаще основного синусового ритма). Суммарное ВСАП на 5, 10 и 15 уд/мин превышает частоту сердечного ритма в покое и составляет 76±10; 86±10 и 96±10 мс; коэффициенты корреляции для измеренных величин ВСАП соответственно равны 0,7, 0,54 и 0,4. Значения ВСАП, определяемые при постоянной стимуляции предсердий, хорошо согласуются с аналогичными данными, получаемыми при преждевременной стимуляции предсердий. Средние значения ±SEM одинаковы при обоих методах. Если метод постоянной стимуляции дает завышенную оценку, то аналогичное завышение обычно отмечается и при преждевременной стимуляции. Коэффициент корреляции результатов двух методов составляет 0,85. При сравнительной оценке величин ВСАП, измеренных непосредственно,' и данных, полученных обоими методами, достоверных отличий не наблюдается (р>0,9); средняя ошибка в обоих случаях составляет приблизительно 30 %. Предварительное введение атропина и пропранолола не предотвращает сокращения длительности потенциала действия клеток синусового узла. Время антероградного проведения до начала серии вызванных возбуждений составило 30 мс, а для первого синусового цикла возврата — 10 мс, что, возможно, отражает смещение водителя ритма в направлении к пограничному гребню.и обусловливает заниженную оценку ВСАП; время антероградного проведения обычно возвращается к исходной величине через 5—10 циклов. В клинических условиях Kang и соавт. [202] находят хорошую корреляцию результатов обоих методов как в контроле (г = 0,80), так и на фоне вегетативной блокады (г=0,85). Кроме того, направленные изменения ВСАП после вегетативной блокады всегда одинаковы. При использовании обоих методов у 12 больных с синдромом слабости синусового узла уменьшение ВСАП наблюдалось у 8 из них, а увеличение — у 4. Авторы полагают, — что увеличение ВСАП на фоне вегетативной блокады является аномальной реакцией для больных, у которых продолжительность цикла, определяемая по окончании стимуляции или после экстрастимула, не указывает на угнетение автоматизма синусового узла. Они предполагают, что увеличение ВСАП может быть связано с собственными аномалиями синоатриального проведения, маскировавшимися ранее активностью симпатической нервной системы. Breithardt и Seipel [203] отмечают плохую корреляцию (г=0,45) величин ВСАП, полученных при постоянной стимуляции предсердий и с помощью преждевременных стимулов. Авторы полагают, что плохая корреляция обусловлена более сильным угнетением автоматизма синусового узла при применении метода преждевременной стимуляции предсердий. Однако Grant и соавт. [201] считают, что подобное расхождение данных связано скорее с недостаточным проникновением возбуждения в синусовый узел и невозможностью его перезапуска при низкой частоте стимуляции; этот эффект исчезает при повышении частоты стимуляции всего на 3 уд/мин (см. выше).
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 439; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.017 с.) |