
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дросселирование газа. Коэффициент Джоуля-ТомсонаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Изменение температуры при снижении давления на 1ата называется коэффициентом Джоуля - Томсона. Этот коэффициент изменяется в широких пределах и может быть положительным (охлаждение) или отрицательным (нагревание). Для природных газов коэффициент Джоуля - Томсона определяется из выражения
где Значение функции f можно определить по графику или рассчитать с погрешностью менее 7% по корреляции Гухмана и Нагарёвой
при 0,82 £ рпр £ 3,5 и 1,6 £ Тпр £ 2,1. Для реальных природных газов коэффициент Джоуля-Томсона, кроме (3.17) можно выразить через коэффициент сверхсжимаемости z:
Изменение температуры газа в процессе изоэнтальпийного расширения при значительном перепаде давления на дросселе называется интегральным дроссель-эффектом. Это изменение можно определить по соотношению
или по энтальпийным диаграммам Приближенно конечную температуру газа в процессе дросселирования находят по формуле
где Интегральный коэффициент Джоуля-Томсона для природного газа изменяется от 2 до 4 К/МПа в зависимости от состава газа, падения давления и начальной температуры газа. Для приближенных расчетов среднее значение коэффициента Джоуля-Томсона можно принять равным 3 К/МПа. Аналитические выражения частных производных от коэффициента сверхсжимаемости позволяют рассчитать изменение температур природных газов при изоэнтальпийном, изоэнтропийном и политропном процессах, т.е. изменение температур природных газов в процессе дросселирования, охлаждения и сжатия в идеальных детандере и компрессоре. Дифференциальный коэффициент Джоуля-Томсона (i =const)
Изменение температуры природного газа в идеальном детандере или компрессоре (S=const)
Изменение температуры в политропном процессе (h=const)
где h* - условный к.п.д. процесса (h*<1 при сжатии газа в компрессоре и h*>1 при расширении газа в детандере). Эффективность использования свободного перепада давления для охлаждения газа в детандере по сравнению с дросселированием его в штуцере можно рассчитать по уравнению
Теплопроводность газов Теплопроводность - физическое свойство вещества, определяющее скорость переноса теплоты и выражаемое уравнением Фурье
где dQ/dt - перенос теплоты посредством проводимости, Дж/с; l - коэффициент теплопроводности вещества (теплопроводность) Вт/(м К); А - площадь, перпендикулярная направлению потока тепла, м2; х - расстояние, м; Т - температура, К. Теплопроводность природной газовой смеси можно определить по приведённой плотности rпр=r/rкр из зависимостей Стила -Тодоса и Тиракьяна. Зависимости Стила-Тодоса: а) rпр> 2
b) 0,5<rпр£ 2
c) rпр£ 0,5
где Коэффициент теплопроводности l0 при атмосферном давлении имеет следующую зависимость от температуры
где
При Тпр=0,8 - 8,0
Зависимость Тиракьяна
где n- число атомов углерода в молекулах; для смеси n=åxini.
Таблицы термофизических свойств Табл. 1 Физико-термодинамические свойства компонент природного газа
Табл. 2 Единицы измерения
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 564; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.233.16 (0.007 с.) |

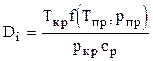 , (3.17)
, (3.17) .
.
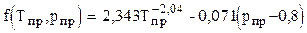 , (3.18)
, (3.18)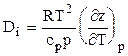 . (3.19)
. (3.19) (3.20)
(3.20)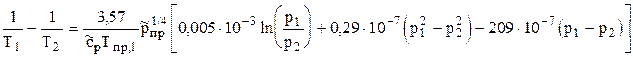 , (3.21)
, (3.21) .
.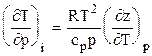 . (3.22)
. (3.22) . (3.23)
. (3.23)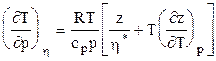 , (3.24)
, (3.24)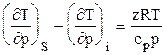 . (3.25)
. (3.25) , (3.26)
, (3.26)
 (3.27)
(3.27)
 , l измеряется в 418.68 Вт/(м К).
, l измеряется в 418.68 Вт/(м К).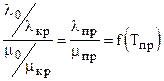 , (3.28)
, (3.28)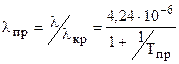 . (3.29)
. (3.29) (3.30)
(3.30)


