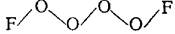Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос № 14. Сложные соединения кислорода в положительных и нулевых степенях окисления. Фториды кислорода. Производные катиона диоксигенила. Комплексные соединения молекулярного кислорода.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Положительная степень окисления кислорода проявляеся в его соединениях с фтором, а также в ионе О2+ - диоксигенил. Простейший представитель такого рода соединений – дифторид кислорода ОF2; его получают при быстром пропускании фтора ч-з 2%-ый раствор щелочи: 2F2 + 2NaOH = OF2 + 2NaF + H2O. Дифторид кислорода – ядовитый газ бледно-желтого цвета, термически устойчив (до 200-250°С), сильный окислитель, эффективный фторирующий агент. В диоксидифториде О2F2 радикал О2+ ковалентно связан с атомами фтора. Это соединение образуется (в виде красной летучей жидкости) в результате непосредственного взаимодействия простых веществ в электрическом разряде или под действием ионизирующих излучений при температуре жидкого воздуха (—190 °С). Согласно спектроскопическим данным молекула О2F2 (μ=0,48 •10-29 Кл-м) по структуре аналогична Н2О2:
Соединение крайне неустойчиво, что определяется низкой энергией разрыва связи ОF (75 кДж/моль). Получены также полиоксидифториды типа О4F2, О5F2, О8F2, существующие лишь при низкой температуре (—190 °С). Предполагают, что их молекулы имеют цепное строение, например:
Термическая устойчивость оксидифторидов уменьшается с увеличением числа атомов в молекуле ОnF2 (n = 2—6). Энергия ионизации молекулы О2 довольно значительная (12,08 эВ), однако при взаимодействии О2 с сильнейшим окислителем РtF6 образуется солеподобное вещество О2+[ РtF6]-: О2 + РtF6 = О2+[ РtF6]-, в котором роль катиона играет молекулярный ион О2+ [: О = О: ] Гексафтороплатинат (V) диоксигенила О2[ РtF6] — парамагнитное вещество красного цвета, плавится с разложением при 219 °С. Синтез этого соединения канадским ученым Н. Бартлетом в 1962 г. послужил толчком к синтезу соединений ксенона, энергия ионизации которого близка к таковой молекулы кислорода. Производные О2+ получены также при взаимодействии О2F2 и О4F2 с резко кислотными фторидами типа ВF3, PF5, AsF5, SbF5, BrF5: О2F2+PF5 = O2[PF6] + ½ F2 О4F2 + 2BF3 = 2O2[BF4] Синтез диоксигенильных солей межно осуществлять длительным нагреванием (при 150—500 °С) смеси кислорода, фтора и порошка соответствующего металла: О2 + 3F2 + М = О2[ МF6] где М — As, Sb, Bi, Nb, Pt,Au, Ru, Rh. Частота валентных колебаний О2+ в диоксигенильных соединенияхблизка к таковой для свободного иона, что подтверждает существование иона О2+ в указанных солях. Межъядерное расстояние в катионе О2+, известное из спектроскопических данных (0,112 нм), как и следовало ожидать, меньше, чем в О2 (0,1207 нм). Ион О2+ имеет один непарный электрон. Энергия диссоциации О2F2, ОF2 (70 кДж/моль) меньше, чем у F2 (159 кДж/моль). Эти фториды — удобная форма хранения фтора, который выделяется при их распаде уже при обычных температурах. В соединениях типа ClO4F, NO3F один из атомов кислорода играет роль мостикового атома, соединяющего атом хлора или азота с атомом фтора. Такой атом кислорода можно рассматривать, как находящийся в состоянии нулевой степени окисления. Рассматриваемые соединения можно получить при взаимодействии с фтором концентрированных растворов НClO4 и НNO3 или твердых солей КСlO4 и КNO3: HNO3 + F2 = NO3F + HF KClO4 + F2 = ClO4F + KF В воде эти соединения разлагаются, выделяя кислород: 2ClO4F + Н2О = 2 НClO4 + 2НF + О2/ Производные с положительной степенью окисления кислорода являются сильнейшими окислителями. Их можно использовать как эффективные окислители ракетного топлива.
Вопрос № 15. Галогены. Положение в ПС. Строение атомов. Изотопный состав, формы нахождения в природе. Изменение по группе атомных радиусов, ионизационных потенциалов, сродства к электрону и ЭО. Валентность и С.О атомов. Галогены находятся в 7 гр главной п/гр. Изменение по группе атомных радиусов, иозационных потенциалов, сродства к эл – ну и ЭО. В ряду F – CI – Вr - J – At 1) радиус атома увеличивается 2) энергия ионизации уменьшается 3) сродство к электрону уменьшается, а у At отсутствует 4) ЭО уменьшается Галогены сильные окислители 5) Ме св - ва усиливаются 6) Ослабление не Ме признаков Валентность и степени ок – я В основном состоянии имеют валентность = 1, а в возбужденном (кроме F) -3,5,7. Галогены легко присоединяют по одному недостающему эл - ну и проявляют ст. ок -я -1. Однако атомы Hal, кроме F, м. проявлять положит СО: +3; +5; +7. СI и Br ещё и +2, +4. Максимальная СО, равная N гр., проявл. в соед – и с кислородом: R2 O7 Нахождение в природе. а) Фтор – довольно распространенный эл – т, и его содержание на Земле составляет ~ 0,03% (мол. доли) Минералы: Ca F2 –плавиковый шпат (флюорит) Na3AIP3 – криолит. Ca5(PO4)3F – фторапатит. В ор – ме чел: в основном зубах и костях Изотопы: 19F (природ), с мас числами 16-21 (искусств) б) CI – встреч. в виде хлоридов Минералы: NaCI – каменная соль NaCI KCI –сильвинит KCI MgCI2. 6H2O – карналлит Содержится в морской воде, входит во все жив. орг - мы Изотопы: 35CI и 37CI + радиактив. изотопы. в) Br и J – распространены в морской воде и нефтяных буровых водах Изотопы: 79Br и 82Br; 127J + искусств. г) At –практически не встречается. Ничтожные кол-ва астата обнаружены в продуктах естеств. радиактив распада урана и тория.
Вопрос № 16. Основные типы соединений галогенов. Изменение по группе устойчивости соединений в высшей С.О атомов. Хаар-р хим связей в соед-ях Признаки металличности йода. Особенности фтора История открытия. Основные типы соединений С водородом Hal образуют устойчивые соед-я галогеноводороды, водные р – ры к - ых - к – ты. М – лы всех Hal состоят из 2 – х атомов: F2, Br2, CI2, J2 – хим связь ковал неполяр. Hal образуют кислородосодержащие к – ты +1: HCIO, HBrO, HJO3 - галогенноватистая (гипогалогеннат) +3: HCIO2 хлористая (хлорит) +5: HCIO3, HBrO3, HJO3 галогенноватая (галогеннат) +7: HCIO4, HBrO4, H5JO6 галогенная (пергалогеннат) С увелич СО возраст устойчивость и сила к – т и уменьшается их ок – ая способность. С водородом НF.
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1097; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.101.7 (0.007 с.) |