Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
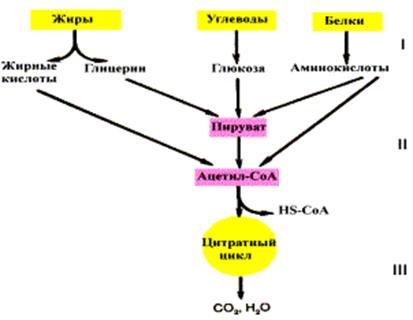
Транспортные формы, выделение углекислого газа из организмаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В тканях диффундирующий в кровь из клеток СО2 большей частью (около 90%) по градиенту концентрации попадает в эритроциты. Движущей силой этого процесса является быстрая, постоянно идущая реакция превращения его в угольную кислоту при участии фермента карбоангидразы. Угольная кислота диссоциирует и подкисляет содержимое эритроцита, что улучшает отдачу оксигемоглобином кислорода (Эффект Бора). Одновременно с концевыми NH2-группами β-цепей гемоглобина связывается 10-12% карбонат-иона с образованием карбаминогемоглобина (H-HbCO2). Остальные бикарбонаты выходят в плазму крови в обмен на ионы хлора (гипохлоремический сдвиг). Пути образования СО2 в метаболизме
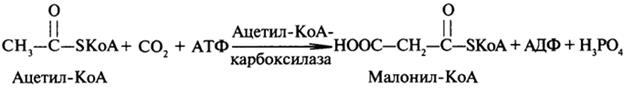
Участие углекислого газа в синтетических процессах Нуклеотиды образуются из аминокислот, углекислого газа и муравьиной кислоты в цепи реакций, для протекания которых требуется большое количество энергии. Непосредственным предшественником двууглеродных единиц в синтезе жирных кислот является не ацетил-КоА, а малонпл-КоА, который образуется в цитоплазме из ацетил-КоА и углекислого газа при участии одной молекулы АТФ под действием ацетил-КоА-карбок-силазы.
В промышленности мочевина синтезируется по реакции Базарова из аммиака и углекислого газа: 2NH3 + CO2 = NH2CONH2 + H2O Витамины Биотин (витамин Н) - принимает участие в обмене жирных кислот и переносе в организме углекисл
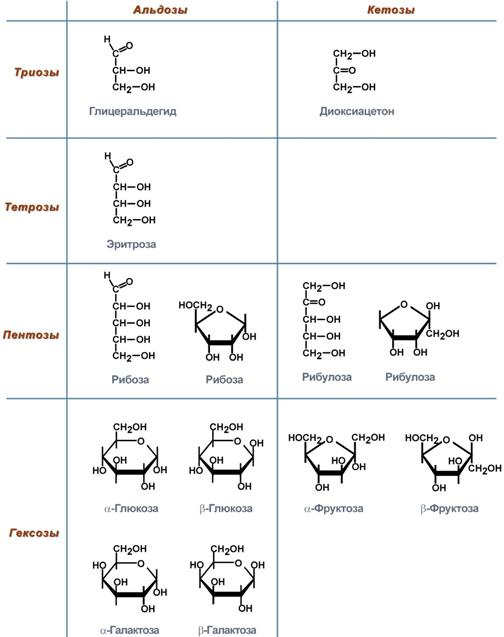
12. Моносахариды – это углеводы, которые не могут быть гидролизованы до более простых форм углеводов. Дисахариды Сахароза – пищевой сахар, в которой остатки глюкозы и фруктозы связаны α1,2-гликозидной связью. В наибольшем количестве содержится в сахарной свекле и тростнике, моркови, ананасах, сорго. Мальтоза – продукт гидролиза крахмала и гликогена, два остатка глюкозы связаны α1,4-гликозидной связью, содержится в солоде, проростках злаков. Лактоза – молочный сахар, остаток галактозы связан с глюкозой β1,4-гликозидной связью, содержится в молоке. В некоторых ситуациях (например, беременность) может появляться в моче. Целлобиоза – промежуточный продукт гидролиза целлюлозы в кишечнике, в котором остатки глюкозы связаны β1,4-гликозидной связью. Здоровая микрофлора кишечника способна гидролизовать до 3/4 поступающей сюда целлюлозы до свободной глюкозы, которая либо потребляется самими микроорганизмами, либо всасывается в кровь.
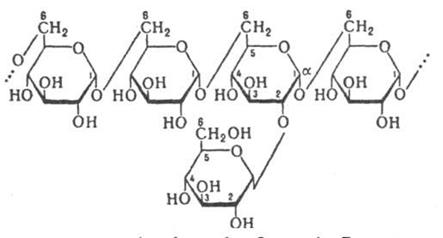
Крахмал – гомополимер α-D-глюкозы. Находится в злаках, бобовых, картофеле и некоторых других овощах. Синтезировать крахмал способны почти все растения. Особенности обмена углеводов в ротовой полости Ф-ия слюны: пища в полости рта подвергается первичной ферментативной обработке, углеводы частично гидролизуются под действием L-амилазы до декстранов и мальтозы. В настоящее время известно, что кариозный процесс может развиться при наличии микроорганизмов в полости рта, избыточном количестве углеводов в пище и контакте углеводов и микроорганизмов с эмалью зуба. Хорошо известно, что прием углеводов вызывает усиленное кислотообразование. Так, прием 10 граммов сахара ведет к возрастанию молочной кислоты в слюне в 10 - 16 раз. Микроорганизмы зубного налета (стрептококки, лактобактерии) из сахарозы, глюкозы, фруктозы, лактозы, крахмала ферментируют кислоты: молочную, муравьиную, масляную и другие. Эти кислоты обусловливают появление кариозных очагов. Первая стадия ферментации полисахаридов во многом напоминает ферментацию сложных органических соединений в рубце [9] и происходит по принципу Эмдена-Мейерхофа-Парнаса с образованием электронов i) пировиноградной кислоты, которые восстанавливаются в нико-тинамид-аденин-динуклеотид2). Характер образующихся продуктов зависит от того, насколько глубоко произошел катаболизм пировиноградной кислоты. Она может расщепиться на уксусную кислоту, С02 и Н2 или на пропионовую кислоту (через лактат или сукцинат), масляную кислоту или этанол. Биосинтез зубного налета Биосинтез декстранов осуществляется путем расщепления сахарозы с послед. переносом остатка глюкозы на акцептор, к-рым м. б. сахароза или растущая цепь декстрана. Р-ция катализируется ферментом декстрансахаразой.
При участии ферментов бактерий зубного налета, из глюкозы синтезируются полимеры — декстран, из фруктозы — леван. Последоват. присоединение остатков -D-фруктофуранозы, к фруктозному остатку 6-кестозы дает леван (в бактериях). Биосинтез муреина. Его первой стадией является синтез характеристичного моносахарида. Вначале в цитоплазме из Тчацетилглюкозамин-1-фосфата и УТФ образуется уридин-N-ацетилглюкозамин. Затем в положение 3 этого нуклеотида (в две стадии) присоединяется остаток молочной кислоты и образуется уридиндифосфо-Ы-ацетилмураминовая кислота [ацетилмураминовая кислота — сахар, встречающийся только в клеточной стенке прокариот]. К ней присоединяются пять аминокислотных остатков, причем концевой всегда является napa-D-аланил-О-аланин.
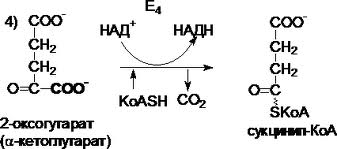
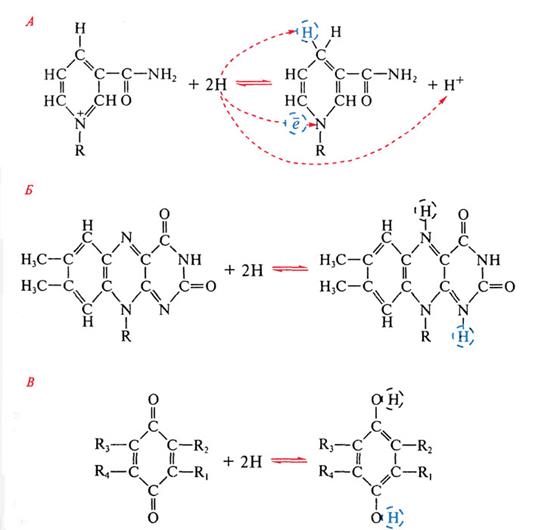
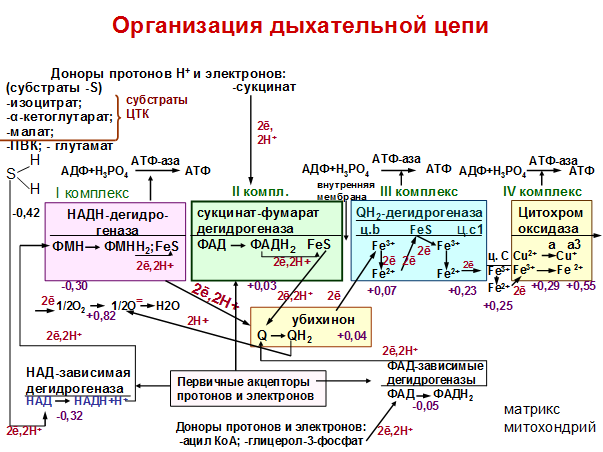
13.НАД(Ф) -зависимые дегидрогеназы, катализирующие протоны водорода от молекул различных субстратов и передающие его на стартовый переносчик дыхательной цепи - НАД(Ф)*Н2-дегидрогеназу, - растворимые ферменты. Дегидрогеназы флавопротеиновой природы, выполняющие аналогичную функцию, могут быть локализованными в мембране (например, сукцинатдегидрогеназа) или существовать в растворимой форме (ацетил-КоA-дегидрогеназы жирных кислот). Водород с них поступает в дыхательную цепь на уровне хинонов. Известно более 250 НАД(Ф)-зависимых дегидрогеназ, активно участвующих в реакциях промежуточного обмена. Но не все из них имеют отношение к энергетическому метаболизму. С помощью дегидрогеназ осуществляется перенос гидрид-иона (2е + Н+ переходит в Н-) от субстрата к НАД(Ф), при этом в среду переходит протон (рис. 93, А).
Атом водорода входит в состав пиридинового кольца, а электрон присоединяется к азоту пиридинового кольца. После восстановления НАД(Ф)*Н2 отщепляется от активного центра фермента и переносится к мембране, где акцептируется флавиновой дегидрогеназой и передает ей восстановительные эквиваленты. Одновременно к дегидрогеназе, освобожденной от кофермента, присоединяется окисленная молекула НАД(Ф), поступающая из среды. Таким образом, особенность НАД(Ф) - их подвижность, позволяющая им курсировать от молекул-доноров электронов, находящихся в цитоплазме, к акцепторам электронов, локализованным в мембране.
В состав флавиновых дегидрогеназ входят флавиновые нуклеотиды, прочно связанные с апоферментом и не отщепляющиеся от него ни на одной стадии каталитического цикла. Окислительно-восстановительные свойства флавопротеинов обусловлены способностью изоаллоксазинового кольца рибофлавина к обратимому переходу из окисленного состояния в восстановленное, при котором происходит присоединение к кольцу 2 электронов в составе атомов водорода (рис. 93, Б). При изучении дыхательных цепей особенно интересны два связанных с мембраной флавопротеина: сукцинатдегидрогеназа, катализирующая окисление сукцината в ЦТК, и НАД(Ф)*Н2-дегидрогеназа, катализирующая восстановление своей флавиновой простетической группы, сопряженное с окислением НАД(Ф)*Н2. Участие в дыхательном электронном транспорте принимают белки, содержащие железосероцентры (рис. 58).
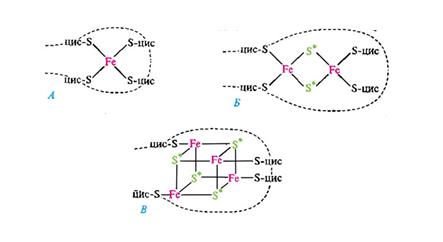
Железосероцентры FeS-белков. Железосероцентр рубредоксина (А); предполагаемые модели железосероцентров Fe2S2-THna (Б) и Fe4S4-типа (В).
Звездочкой отмечена неорганическая кислотолабильная сера; прерывистой линией обозначена полипептидная цепь; цис - цистеин. Они входят в состав некоторых флавопротеинов, например сукцинат и НАД(Ф)*Н2-дегидрогеназ, или же служат в качестве единственных простетических групп белков. Дыхательные цепи содержат большое число FeS-центров. В митохондриальной электронтранспортной цепи функционирует, вероятно, около дюжины таких белков. В зависимости от строения FeS-центры могут осуществлять одновременный перенос 1 или 2 электронов, что связано с изменением валентности атомов железа. Хиноны - жирорастворимые соединения, имеющие длинный терпеноидный "хвост", связанный с хиноидным ядром, способным к обратимому окислению - восстановлению путем присоединения 2 атомов водорода (рис. 93, В). Наиболее распространен убихинон, функционирующий в дыхательной цепи на участке между флавопротеинами и цитохромами. В отличие от остальных электронных переносчиков хиноны не связаны со специфическими белками. Небольшой фонд убихинона растворен в липидной фазе мембран. Цитохромы, принимающие участие на заключительном этапе цепи переноса электронов, представляют собой группу белков, содержащих железопорфириновые простетические группы (гемы). С помощью цитохромов осуществляется перенос электронов, в процессе которого меняется валентность железа:
Fe++ переходит обратимо в Fe+++ + e В митохондриях обнаружено пять цитохромов (b, с, с1, а, а3), различающихся между собой спектрами поглощения и окислительно- восстановительными потенциалами. Различия по этим параметрам обусловлены белковыми компонентами цитохромов, природой боковых цепей их порфиринов и способом присоединения гема к белкам. Конечные цитохромы (а+а3) передают электроны на молекулярный кислород, представляя собой собственно цитохромоксидазу, в реакционном центре которой содержатся помимо двух гемов два атома меди. Образование воды имеет место при переносе на молекулу кислорода 4 электронов. Некоторые цитохромоксидазы осуществляют перенос на О2 только 2 электронов, следствием чего является возникновение перекиси водорода. Перекись водорода далее разрушается каталазой или пероксидазой. Таким образом, дыхательная цепь переноса электронов в митохондриях состоит из большого числа промежуточных переносчиков, осуществляющих электронный транспорт с органических субстратов на О2. Последовательность их расположения, представленная на рис. 94, подтверждается различного рода данными: значениями окислительно- восстановительных потенциалов переносчиков, ингибиторным анализом.
Схема переноса электронов в дыхательной цепи митохондрий:
ФМН - простетическая группа НАД(Ф)*Н2-дегидрогеназы; ФАД - простетическая группа сукцинатдегидрогеназы; УХ - убихинон; b, с, c1, a, a1 - цитохромы. Сплошными линиями обозначены процессы, протекающие в мембране; прерывистыми - в цитозоле клетки; зигзагообразной линией показаны места действия ингибиторов. Обнаружены ингибиторы, специфически действующие на определенные участки дыхательной цепи. Амитал и ротенон блокируют перенос электронов на участке до цитохрома b, действуя предположительно на НАД(Ф)*Н2- дегидрогеназу. Антимицин A (антибиотик, продуцируемый Streptomyces) подавляет перенос электронов от цитохрома b к цитохрому с1. Цианид, окись углерода и азид блокируют конечный этап переноса электронов от цитохромов а+а3 на молекулярный кислород, ингибируя цитохромоксидазу. Если блокировать перенос электронов в электронтранспортной цепи определенными ингибиторами, то переносчики, находящиеся на участке от субстрата до места действия ингибитора, будут в восстановленной, а переносчики за местом действия ингибитора - в окисленной форме. АН2 + НАД(Ф)+ = А + НАД(Ф)Н + Н+, где АН2 восстановленная форма субстрата. А — окисленная форме субстрата. Эти реакции состоят в обратимом переносе двух восстановительных эквивалента от субстрата к окисленному никотинамидному К. Один восстановительный эквивалент присутствует в восстановленном К. в виде атома водорода, другой — в виде электроне, при этом катион второго атома водорода переходит в среду а виде свободного Н+. Обнаружено около 350 НАД(Ф)-зависимых дегидрогеназ, как правило, специфичных в отношении либо НАД, либо НАДФ. Обычно связь никотинамидных и других нуклеотидных К. с белками легко диссоциирует. НАД-зависимые дегидрогеназы участвуют преимущественно в процессах катаболизма (например, в клеточном дыхании), в НАДФ-зависимые — главным образом в анаболических процессах (восстановительных биосинтетических реакциях). Содержание никотинамидных К., соотношение между их окисленными и восстановленными формами (НАДН и НАДФН), к также величию отношения НАД/НАДФ являются показателями активности метаболических процессов в ткани, характеризуют ее функциональное состояние. В организме НАД и НАДФ синтезируются из никотиновой кислоты (ниацина, или витамина РР) или никотинамида, поэтому недостаточность ниацина ведет к нарушению биосинтеза никотинамидных коферментов.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1126; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.134.77 (0.011 с.) |